| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点整理《化学基本概念》答题技巧(2017年最新版)(二)
参考答案:D 本题解析:NF3中氮元素化合价为+3价,2/3降低为+2价的NO,1/3升高为+5价的HNO3,为还原剂;A、NF3是氧化剂和还原剂,错误;B、还原剂与氧化剂的物质的量之比为1:2,错误;C、若生成0.2mol HNO3,则转移0.4mol电子,错误;D、正确。 本题难度:一般 2、选择题 木炭与浓硫酸反应可表示为:C +2H2SO4(浓) 参考答案:(1)CO2 、SO2、 H2O (2)还原剂 被还原 (3)1 本题解析:氧化物是由氧和另一种元素组成的化合物,即氧化物的组成元素有两种,其中一种为氧元素。根据氧化物的定义可知该反应的反应物和生成物中,属于氧化物的是CO2 、SO2、H2O。(2)在反应中C的化合价由反应前单质中的0价变为反应后CO2中的+4价,化合价升高,失去电子,被氧化,作还原剂;H2SO4中的S的化合价一部分由反应前的+6价变为反应后SO2中的+4价,化合价降低,得到电子,被还原,作氧化剂,还有一部分未参加氧化还原反应,起酸的作用,提供酸根离子用来结合形成盐。每有2摩尔的浓H2SO4参加反应,产生1摩尔的SO2。 本题难度:一般 3、选择题 下列关于Na及其化合物的叙述正确的是 |
参考答案:C
本题解析:A、钠与盐溶液反应,先与水反应,生成的氢氧化钠再与盐反应,本题最终生成氢氧化铁,不会生成铁单质,错误;B、钠是不足,反应的钠的物质的量相等,转移的电子数相等,错误;C、Na2O与Na2O2中阴阳离子个数比均为1:2,正确;D、过氧化钠既是氧化剂又是还原剂,生成1molO2时,有1mol过氧化钠被还原,错误。
考点:考查Na、Na2O、Na2O2的性质。
本题难度:一般
4、选择题 向某FeBr2溶液中,通入1.12L(标准状况)的Cl2,测得溶液中c(Br-)=3c(Cl-)=0.3mol/L。反应过程中溶液的体积变化不计。则下列说法中正确的是
A.原溶液的浓度为0.1mol/L
B.反应后溶液中c(Fe3+)=0.1mol/L
C.反应后溶液中c(Fe3+)=c(Fe2+)
D.原溶液中c(Br-)=0.4mol/L
参考答案:B
本题解析:试题分析:还原性强弱:I-﹥Fe2+﹥Br-,在FeBr2溶液中,通入Cl2过程中,Fe2+先反应,反应完之后是Br-。n(Cl2)=0.05mol,反应后有Br-,说明Cl2已全部反应完。n(Cl-)=0.1mol。c(Cl-)="0.1" mol/L,V(aq)=1L?。
所以,溶液中含有的n(Br-)=0.3mol。若溶液中Br-并没参加反应,则有Fe2+部分反应或者是恰好反应完。则n(FeBr2)=0.15mol,n(Fe2+)="0.15mol," 通入0.05mol Cl2后,反应掉n(Fe2+)="0.1" mol,生成n(Fe3+)="0.1" mol,剩余n(Fe2+)="0.05" mol。故B正确。
考点:氧化还原反应的计算及规律(优先律)
本题难度:困难
5、选择题 贵州凤岗的“富锌富硒”茶已享誉全国,因富含硒元素,有延年益寿、抗衰老等作用。但研究表明单质硒可能成为环境污染物,通过与浓盐酸、浓H2SO4反应可回收Se。在回收过程中涉及到如下两个化学反应:①SeO2+4KI+4HCl=Se+2I2+4KCl+2H2O;②Se+2H2SO4(浓)=2SO2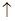 + SeO2+2H2O。下列叙述正确的是( )
+ SeO2+2H2O。下列叙述正确的是( )
A.反应①中Se是氧化产物,I2是还原产物
B.反应②中浓H2SO4是氧化剂,SeO2是还原产物
C.反应①中每有1.0mol I2生成,转移电子数目为4 NA
D.SeO2、H2SO4(浓)、I2的氧化性由强到弱的顺序是H2SO4(浓)> SeO2> I2
参考答案:D
本题解析:A.在反应①中Se是还原产物,I2是氧化产物,错误;B.在反应②中浓H2SO4是氧化剂,SeO2是氧化产物,错误;C.在反应①中每有1.0mol I2生成,转移电子数目为2 NA,错误;D.在反应中氧化剂的氧化性强于氧化产物的氧化性,所以把两个反应中物质的氧化性强弱结合起来,则SeO2、H2SO4(浓)、I2的氧化性由强到弱的顺序是H2SO4(浓)> SeO2> I2,正确。
考点:考查氧化还原反应的概念、电子转移、氧化性强弱的比较的知识。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点讲解《化学实验的.. | |