1、填空题 由amolFe+bmolFe2O3组成的混和物,用足量的盐酸溶解。随着a/b的不同,反应产物各不相同。按照a/b的不同比值,结合有关氧化还原的反应竞争顺序,填写下列表格内容。表格可不填满,若不足可添加表格。
a/b
| 氧化还原反应主要产物
| 有关的离子方程式
|
?
| ?
| ?
|
?
| ?
| ?
|
?
| ?
| ?
|
?
| ?
| ?
|
?
| ?
| ?
2、选择题 下列说法正确的是
A.金属原子失电子越多,其还原性越强
B.CH4的摩尔质量为16g
C.10 mL质量分数为98%的H2SO4,用水稀释至100 mL,H2SO4的质量分数为9.8%
D.电解质物质本身可能导电
|
3、选择题 已知2FeCl3?+?2KI?=?2FeCl2?+?2KCl?+?I2,H2S?+?I2?=?2HI?+?S,下列叙述正确的是
[? ]
A.?氧化性:Fe3+>I2>S?
B.?氧化性:I2>S>Fe3+
C.?还原性:Fe2+>I->H2S?
D.?还原性:Fe2+>H2S>I-
4、实验题 某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
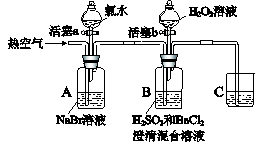
实验记录如下:
?
| 实验操作
| 实验现象
|
I
| 打开活塞a,滴加氯水,关闭活塞a
| A中溶液变为红棕色。
|
II
| 吹入热空气
| A中红棕色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化。
|
III
| 停止吹入空气,打开活塞b,逐滴加入H2O2溶液
| 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色。
|
?
请回答下列问题:
(1)A中反应的离子方程式是?。
(2)实验操作II吹入热空气的目的是?。
(3)装置C的作用是?,C中盛放的药品是?。
(4)实验操作III,混合液逐渐变成红棕色,其对应的离子方程式?。
(5)由上述实验得出的结论是?。
(6)实验反思:
①有同学认为实验操作II吹入的热空气,会干扰(5)中结论的得出,你认为是否干扰,理由是?。
②实验操作III,开始时颜色无明显变化的原因是(写出一条即可):?
?。
5、选择题 实现下列反应需要加入氧化剂的是(?)
A.NaOH →Na2CO3
B.SO2→SO3
C.H2SO4→H2
D.CaCO3→CO2