1、选择题 在一种酸性溶液中可能存在Fe3+、NO3-、Cl-、I-中的一种或几种离子,向该溶液中加入溴水,溴单质被还原,由此可推断溶液中
A.一定含有I-,不能确定是否含有Cl-
B.可能含有NO3-、Cl-和I-
C.可能含有NO3-
D.肯定含有Fe3+
参考答案:A
本题解析:略
本题难度:简单
2、选择题 能使淀粉碘化钾试纸变蓝的物质是(?)
A.氯水
B.碘水
C.碘化钠溶液
D.溴化钠溶液
参考答案:A、B
本题解析:能使淀粉碘化钾试纸变蓝的物质一种是本来就有I2存在,如A,一种是生成I2,如B,Cl2+2KI=2KI+I2
本题难度:简单
3、填空题 为了探究三种气态氧化物(SO2、NO2、CO2)的性质,某同学设计了一组实验:
实验一:探究三种气体在水中的溶解性,用三支相同的试管收集满三种气体,倒置在盛满水的烧杯中,一段时间后,观察到的现象如图A、B、C所示。

(1)在相同条件下,三种气体在水中溶解度最大的是________(写化学式)写出A烧杯中发生反应的化学方程式:____?。如果在三只烧杯中分别滴几滴紫色石蕊试液,可观察到的现象是_____________________?。
实验二:用三只集气瓶收集满二氧化硫、二氧化氮气体,然后将其倒置在水槽中。分别缓慢通入适量O2或Cl2,如图D、E、F所示。一段时间后,D、E装置的集气瓶中充满溶液,F装置的集气瓶中还有气体剩余。
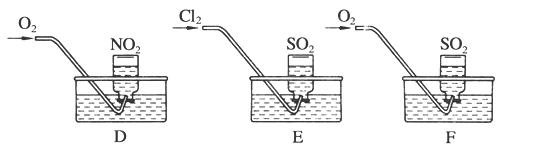
(2)实验二中装置D的集气瓶最终充满溶液(假设瓶内液体不扩散):
①写出装置D中总反应的化学方程式:
_______________________________________________。
②假设该实验条件下,气体摩尔体积为a L·mol-1。则装置D的集气瓶中所得溶液溶质的物质的量浓度为____________________。
(3) 写出实验F通入氧气后,发生反应的化学方程式:____________________________。
(4)溶液充满集气瓶后,在E装置的水槽里滴加硝酸钡溶液,可能观察到的现象为________,用有关的离子方程式解释原因:________________________。
参考答案:(1)NO2
3NO2+H2O=2HNO3+NO?溶液都变红色
(2)①4NO2+O2+2H2O=4HNO3?②1/a mol·L-1
(3) 2SO2+O2+2H2O= 2H2SO4
(4)出现白色沉淀? Cl2+SO2+2H2O=2Cl-+SO+4H+? Ba2++SO=BaSO4↓
本题解析:(1)NO2在水中的溶解度最大;A试管剩余气体的体积为试管体积的1/3,所以A中气体为NO2,NO2与H2O反应的方程式为:3NO2+H2O=2HNO3+NO;SO2与H2O反应生成H2SO3,NO2与H2O反应生成HNO3,CO2与水反应生成H2CO3,都显酸性,滴入石蕊试液变红。
(2)①由3NO2+H2O=2HNO3+NO和2NO+O2=2NO2,可推出总反应化学方程式为:4NO2+O2+2H2O=4HNO3
②设集气瓶的体积为VL,则充满的NO2也为VL,HNO3的浓度为:VL÷aL/mol÷VL=1/a mol·L-1。
(3)O2氧化SO2,化学方程式为: 2SO2+O2+2H2O=2H2SO4
(4)Cl2在H2O存在的条件下把SO2氧化,生成SO42?,SO42?与Ba2+反应生成BaSO4沉淀,试液现象为:出现白色沉淀;反应的离子方程式为:Cl2+SO2+2H2O=2Cl-+SO+4H+ Ba2++SO=BaSO4↓。
本题难度:一般
4、选择题 将13.4克KCl和KBr的混合物,溶于水配成500? mL溶液,通入过量的Cl2,反应后将溶液蒸干,得固体11.175克。则原来所配溶液中K+、Cl-、Br-的物质的量之比为(?)
A.3∶2∶1
B.1∶2∶3
C.1∶3∶2
D.2∶3∶1
参考答案:A
本题解析:关键掌握氯、溴、碘的化学性质及金属活动性顺序表,明确题意给出的信息。只有透过现象看本质,才能真正准确地把握问题并解决问题。
本题难度:一般
5、选择题 某城市以“液氯泄漏”作为应急预警演习的项目,演习时下列防护措施合理的是
[? ]
①及时向上风口和地势较高处转移疏散人群;
②及时戴上用烧碱溶液湿润过的口罩;
③用高压水枪向泄漏口附近喷洒稀碱液并设法控制氯气泄漏;
④及时戴上用稀纯碱溶液湿润过的口罩;
⑤就近向地下商场转移。
A.②③④⑤
B.①②④⑤
C.①③④⑤
D.①③④
参考答案:D
本题解析:
本题难度:简单