1、填空题 在一固定容积的密闭容器中,保持一定温度,在一定条件下发生以下反应:
2A(g)+B(g) 3C(g)。
3C(g)。
已知加入1 mol A和2 mol B且达到平衡后,生成了a mol C。
(1)达到平衡时,C在反应混合气中的体积分数是______(用含a的代数式表示)。
(2)在相同的实验条件下,若在同一容器中改为加入2 mol A 和4 mol B,达到平衡后,C的物质的量为______mol(用含a的代数式表示)。此时C在反应混合气中的体积分数与原平衡相比________(填“增大”、“减小”或“不变”)。
(3)在相同实验条件下,若在同一容器中改为加入2 mol A和5 mol B,若要求平衡后C在反应混合气中的体积分数仍与原平衡相同,则还应加入________ mol C。
参考答案:(1)a/3 (2)2a 不变 (3)1
本题解析:(1)根据方程式可知,反应前后体积是不变的,所以达到平衡时,C在反应混合气中的体积分数是 。
。
(2)由于反应前后体积是不变,所以在同一容器中改为加入2 mol A 和4 mol B时平衡是等效的,所以达到平衡后,C的物质的量为2amol,此时C在反应混合气中的体积分数与原平衡相比不变。
(3)由于反应前后体积是不变,所以要满足平衡等效,则最初的投料比是相同的。设C的物质的量为xmol,则转化成A和B的物质的量分别为2X/3和X/3,则有(2+2x/3):(5+x/3)=1:2,解得x=1mol。
点评:该题是中等难度的试题,试题注重基础,侧重能力的考查和训练。该题的关键是明确等效平衡的判断依据,然后结合题意灵活运用、分析判断即可,有利于培养学生的逻辑思维能力和抽象思维能力。
本题难度:一般
2、选择题 一定温度下,将NO2与SO2以体积比1∶2置于密闭容器中发生NO2(g)+SO2(g) SO3(g)+NO(g) ΔH="-41.8" kJ·mol-1,测得上述反应平衡时NO2与SO2体积比为1∶6,下列说法正确的是( )
SO3(g)+NO(g) ΔH="-41.8" kJ·mol-1,测得上述反应平衡时NO2与SO2体积比为1∶6,下列说法正确的是( )
A.平衡常数K=
B.达到平衡后NO2与SO2的转化率相等
C.SO3和NO的体积比保持不变可以证明达到平衡状态
D.在反应过程中可能存在c(NO2)=c(SO2)
参考答案:A
本题解析:设NO2初始浓度为1 mol·L-1,依据“三部曲”计算
NO2(g)+SO2(g) SO3(g)+NO(g)
SO3(g)+NO(g)
始态(mol·L-1):? 1? 2? 0? 0
反应(mol·L-1):? x? x? x? x
终态(mol·L-1):? 1-x? 2-x? x? x
 ,解得x=0.8,K=
,解得x=0.8,K= ,A选项正确;NO2与SO2的转化率应为2∶1,B错误;SO3与NO的体积不论平衡与否,均为1∶1,C错误;依据c(NO2)="(1-x)" mol、c(SO2)="(2-x)" mol可知D选项错误
,A选项正确;NO2与SO2的转化率应为2∶1,B错误;SO3与NO的体积不论平衡与否,均为1∶1,C错误;依据c(NO2)="(1-x)" mol、c(SO2)="(2-x)" mol可知D选项错误
本题难度:一般
3、填空题 (6分)在一定条件下,反应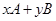

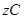 达到平衡:
达到平衡:
(1)若A、B、C均为气体,则该反应的平衡常数表达式为________;
(2)若A、B、C均为气体,减压后平衡向逆反应方向移动,则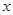 、y、z间的关系是________________;
、y、z间的关系是________________;
(3)若已知C是气体,且 ,在增大压强时,若平衡发生移动,则一定向________(填“正”或“逆”)反应方向移动;
,在增大压强时,若平衡发生移动,则一定向________(填“正”或“逆”)反应方向移动;
(4)已知B、C是气体,当其他条件不变时,增大A的物质的量,平衡不移动,则A为________态;
(5)加热后C的质量分数减少,则正反应是________(填“放热”或“吸热”)反应。升高温度达到新的平衡后,该反应的平衡常数将变________(填“大”或“小”)
参考答案:(6分,每空1分)(1)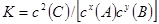
(2)
(3)逆
(4)固或液
(5)放热?小
本题解析:(1)平衡常数的表达式为生成物浓度积除以反应物浓度积;(2)减压平衡朝体积增大的方向移动,故逆反应体积增大,有x+y>z;(3)增大压强平衡移动,说明体积有变化,C为气体,故A、B有一种不是气体,平衡朝体积减小方向,也就是逆向移动。(4)改变A的量,平衡不移动,说明A不存在浓度,为固体或纯液体;(5)加热c的质量分数减小,故向逆向移动,逆向吸热,正向放热。平衡常数减小。
本题难度:一般
4、选择题 对于反应A2+3B2=2C来说,以下化学反应速率的表示中,反应速率最快的是
[? ]
A.v(B2)=0.8 mol/ (L·s)
B.v(A2)=0.4 mol/ (L·s)
C.v(C)=0.6 mol/ (L·s)
D.v(B2)= 4.2 mol/ (L·s)
参考答案:D
本题解析:
本题难度:简单
5、选择题 已知:①CO(g)+H2O(g) CO2(g)+H2(g)?ΔH1="-41.2" kJ/mol
CO2(g)+H2(g)?ΔH1="-41.2" kJ/mol
②CH4(g)+CO2(g) 2CO(g)+2H2(g)? ΔH2="+247.3" kJ/mol
2CO(g)+2H2(g)? ΔH2="+247.3" kJ/mol
③CH4(g)+H2O(g) CO(g)+3H2(g)?ΔH3
CO(g)+3H2(g)?ΔH3
若反应③在一体积恒定为1 L的密闭容器中进行,测得CH4的物质的量浓度随反应时间的变化如图所示。下列有关叙述错误的是
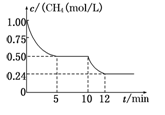
A.ΔH3=+206.1 kJ/mol
B.反应③进行到10 min时,改变的外界条件可能是升高温度
C.反应③进行的过程中,0~5 min这段时间共吸收的热量为103.05 kJ
D.当反应③平衡后,向容器中通入CH4,平衡向正反应方向移动,CH4的转化率将增大
参考答案:D
本题解析:A、正确,①+②得△H3=-41.2 kJ/mol+247.3 kJ/mol=+206.1 kJ/mol
B、正确,升高温度,平衡正向移动;C、正确,206.1 kJ/mol×0.5mol="103.05" kJ;D、不正确,CH4的转化率将减小。选D。
本题难度:一般