1、填空题 常温下,将0.05 mol·L-1盐酸溶液和未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的pH=12。用上述NaOH溶液12.5 mL和pH=3的某一元弱酸HA溶液20.0mL恰好完全反应生成NaA。
(1)此一元弱酸的物质的量浓度为?;
(2)此条件下该一元弱酸的电离平衡常数为?。
参考答案:
(1)0.025 mol·L-1?(2)4.0×10-5
本题解析:(1)首先求出题出所给的氢氧化钠的物质的量浓度c(NaOH):设盐酸和氢氧化钠的体积分别为1L和2L,那么有如下关系: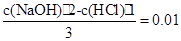 ,解之得:c(NaOH)="0.04" mol·L-1
,解之得:c(NaOH)="0.04" mol·L-1
用上述NaOH溶液12.5 mL和pH=3的某一元弱酸HA溶液20.0mL恰好完全反应生成NaA,表明有如下关系:0.04 mol·L-1×12.5 mL=c(某酸) ×20 mL,解之得:c(某酸)=? 0.025 mol·L-1
(2)一元弱酸HA溶液pH=3,? HA?=? H+?+? A-
起始:? 0.025?0? 0
转化:?0.001? 0.001? 0.001
平衡:? 0.024? 0.001? 0.001
因此此条件下该一元弱酸的电离平衡常数为:?
本题难度:一般
2、选择题 有A、B、C、D四种一元酸溶液,对它们进行的有关实验及其结果分别为:(1)在物质的量浓度相同的A、C两溶液中,都滴加几滴甲基橙时,A溶液呈黄色,C溶液呈橙色(2)B的钠盐溶液的pH值小于C的钠盐溶液的pH值(3)A酸与D的盐反应生成易溶于水的A的盐和D酸。由此可以确定这四种酸的酸性由强到弱的正确排列顺序为
A.B>C>A>D? B.A>C>B>D C.D>A>C>B? D.C>B>A>D
参考答案:A
本题解析:甲基橙的变色范围是3.1~4.4,所以根据A溶液呈黄色,C溶液呈橙色可知,A的酸性弱于C的。酸越弱,相应的钠盐越容易水解,所以根据(2)可知,B的酸性强于C的。根据较强的酸制取较弱的酸可知,A的酸性强于D的,所以答案选A。
本题难度:一般
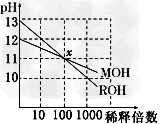
3、选择题 两种一元碱MOH和ROH的溶液分别加水稀释,溶液pH的变化如图所示,下列叙述不正确的是
[? ]
A、MOH是一种弱碱?
B、在x点,c(M+)=c(R+)
C、稀释前,c(ROH)=10?c(MOH)?
D、稀释前MOH溶液和ROH溶液中由水电离出的c(OH-)? 后者是前者的?10倍?
参考答案:CD
本题解析:
本题难度:一般
4、简答题 已知水在25℃和99℃时,其电离平衡曲线如图所示:
(1)则25℃时水的电离平衡曲线应为______(A或B).
(2)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的?pH=7,则NaOH溶液与H2SO4溶液的体积比为______.
(3)99℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,a与b之间应满足的关系是______.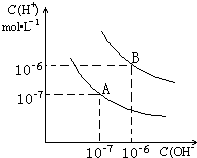
参考答案:(1)纯水中,水的电离是吸热反应,升高温度促进水电离,C(OH-)、C(H+)增大且C(OH-)=C(H+),所以25℃时水的电离平衡曲线应为A,故选A;
(2)25℃时,将pH=9的NaOH溶液中C(OH-)=10-5 mol/L,pH=4的H2SO4溶液中C(H+)=10-4 mol/L,要使混合溶液呈中性,则氢氧根离子的物质的量等于氢离子的物质的量,设碱的体积为xL,酸的体积为yL,则10-5 mol/L×xL=10-4 mol/L×yL,
所以x:y=10-4:10-5=10:1,
故答案为:10:1;
(3)99℃时,pH1=a的某强酸溶液中C(H+)=10-a mol/L,pH2=b的某强碱溶液C(OH-)=10b-12 mol/L,溶液呈中性,则酸中氢离子的物质的量应等于碱中氢氧根离子的物质的量,所以100×10-a=1×10b-12,a+b=14,故答案为:a+b=14.
本题解析:
本题难度:一般
5、选择题 下列事实一定能说明HNO2为弱电解质的是
①常温下Na NO2溶液的PH>7 ②10mL1mol/L HNO2恰好与10mL1mol/LNaOH完全反应③HNO2与NaCl不能反应④0.1mol/L HNO2溶液的PH=2.1
A:①②③④ B:②③④ C:①④ D:②④
参考答案:C
本题解析:略
本题难度:一般