1、填空题 VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是______;
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为______;
(3)Se原子序数为______,其核外M层电子的排布式为______;
(4)H2Se的酸性比H2S__________(填“强”或“弱”)。气态SeO3分子的立体构型为______平面三角形,SO32-离子的立体构型为______三角锥形;
(5)H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释:
①H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因:?;第一步电离后生成的负离子较难再进一步电离出带正电荷的氢离子;
②H2SeO4比H2SeO3酸性强的原因:______;
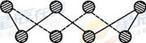
(6)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如图所示,其晶胞边长为540.0 pm,密度为____________(列式并计算),a位置S2-离子与b位置Zn2+离子之间的距离为___________________pm(列式表示)。

参考答案:(1)sp3;
(2)O>S>Se;
(3)34;3s23p63d10;
(4)强;平面三角形;三角锥形;
(5)①H2SeO3和H2SeO4可表示为 (HO)SeO和 (HO)SeO2.H2SeO3中Se为+4价,而H2SeO4中Se为+6价,正电性更高.导致Se﹣O﹣H中的O原子更向Se偏移,越易电离出H+;
(6)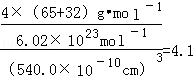 ;
; 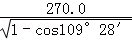 或
或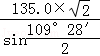 或
或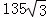
本题解析:(1)由S8分子结构可知,在S8分子中S原子成键电子对数为2,孤电子对数为2,即价层电子对数为4,因此S原子采用的杂化轨道方式为sp3,故答案为:sp3;(2)同主族元素从上到下元素的第一电离能逐渐减小,则有O>S>Se,故答案为:O>S>Se;
(3)Se位于元素周期表第四周期第ⅥA族,原子序数为34,其核外电子排布式为1s22s22p63s23p63d104s24p4,则核外M层电子的排布式为3s23p63d10,故答案为:34;3s23p63d10;(4)同主族元素对应的氢化物中,元素的非金属性越强,对应的氢化物的酸性越弱,则H2Se的酸性比H2S强,气态SeO3分子中Se形成3个δ键,没有孤电子对,为平面三角形分子,SO32﹣中S形成3个δ键,孤电子对数为 =1,则为三角锥形,
=1,则为三角锥形,
故答案为:强;平面三角形;三角锥形;(5)①酸第一步电离产生的酸根阴离子带有负电荷,吸引H+,同时产生的H+抑制第二步电离,所以H2SeO4和H2SeO3第一步电离程度大于第二部电离程度,导致第一步电离后生成的负离子较难再进一步电离出带正电荷的氢离子,故答案为:第一步电离后生成的负离子较难再进一步电离出带正电荷的氢离子;
②H2SeO3的分子结构为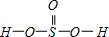 ,Se为+4价,而H2SeO4的分子结构为
,Se为+4价,而H2SeO4的分子结构为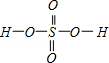 ,Se为+6价,后者Se原子吸电子能力强,导致Se﹣O﹣H中的O原子更向Se偏移,则羟基上氢原子更容易电离出H+,故答案为:H2SeO3和H2SeO4可表示为 (HO)SeO和 (HO)SeO2.H2SeO3中Se为+4价,而H2SeO4中Se为+6价,正电性更高.导致Se﹣O﹣H中的O原子更向Se偏移,越易电离出H+;(6)晶胞中含有S离子位于顶点和面心,共含有
,Se为+6价,后者Se原子吸电子能力强,导致Se﹣O﹣H中的O原子更向Se偏移,则羟基上氢原子更容易电离出H+,故答案为:H2SeO3和H2SeO4可表示为 (HO)SeO和 (HO)SeO2.H2SeO3中Se为+4价,而H2SeO4中Se为+6价,正电性更高.导致Se﹣O﹣H中的O原子更向Se偏移,越易电离出H+;(6)晶胞中含有S离子位于顶点和面心,共含有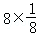 +6×
+6×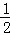 =4,Zn离子位于体心,共4个,则晶胞中平均含有4个ZnS,质量为
=4,Zn离子位于体心,共4个,则晶胞中平均含有4个ZnS,质量为 ,晶胞的体积为(540.0×10﹣10cm)3,则密度为
,晶胞的体积为(540.0×10﹣10cm)3,则密度为 g?cm﹣3,
g?cm﹣3,
四个Zn2+在体内的四个小立方体的中心,不在同一平面上,过b向上面作垂线,构成直角三角形,两边分别为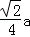 ;
; a,即可求出斜边为
a,即可求出斜边为 a(a 为晶胞边长),则a位置S2﹣离子与b位置Zn2+离子之间的距离为
a(a 为晶胞边长),则a位置S2﹣离子与b位置Zn2+离子之间的距离为 ×540.0pm=135
×540.0pm=135 pm或
pm或 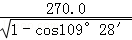 或
或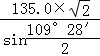 ,
,
故答案为: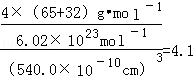 ;
; 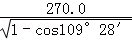 或
或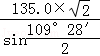 或
或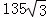
本题难度:一般
2、选择题 下列判断中一定正确的是( )
A.若R2-和M+的电子层结构相同,则原子序数:R>M
B.若X、Y都是气态氢化物,且相对分子质量:X>Y,则沸点:X>Y
C.若M、N是同主族元素,且原子序数:M>N,则非金属性:M>N
D.若X、Y属于同主族元素,且相对原子质量:X>Y,则X失电子能力比Y的强
参考答案:A、若R2-和M+的电子层结构相同,M位于R的下一周期,原子序数M>R,故A错误;
B、气态氢化物相对分子质量大,沸点不一定高,如HF与HCl,HF中存在氢键,沸点高于同族其它氢化物,故B错误;
C、M、N是同主族元素,原子序数M>N,同主族自上而下,非金属性减弱,非金属性:N>M,故C错误;
D、若X、Y属于同主族元素,且相对原子质量X>Y,则X电子层多,同主族自上而下,金属性增强,则X失电子能力比Y的强,故D正确.
故选:D.
本题解析:
本题难度:简单
3、选择题 下列组合中,属于含有极性键的非极性分子的是 ( )
A.C2H4、C2H2、CO2
B.CH4、CHCl3、CO2
C.Cl2、H2、N2
D.NH3、H2O、SO2
参考答案:A
本题解析:B中CHCl3是极性分子,B不正确;C中都是含有非极性键的非极性分子,C不正确;D中都是含有极性键的极性分子,D不正确,所以答案选A。
点评:在判断分子的极性时,不能仅依据化学键,还需要根据分子的结构特点综合分析和判断。
本题难度:一般
4、选择题 下列物质中,只含有非极性共价键的是( )
A.H2O2
B.I2
C.CaC12
D.NaOH
参考答案:B
本题解析:
本题难度:一般
5、选择题 下列事实能够证明HCl是共价化合物而不是离子化合物的是
[? ]
A.HCl易溶于水
B.HCl溶于水能导电
C.HCl的熔点低
D.液态的HCl不导电
参考答案:D
本题解析:
本题难度:简单