1、简答题 某研究性学习小组用不纯的氧化铝(杂质为Fe2O3)为原料,设计了冶炼铝的以下工艺流程(部分反应产物没有标出):
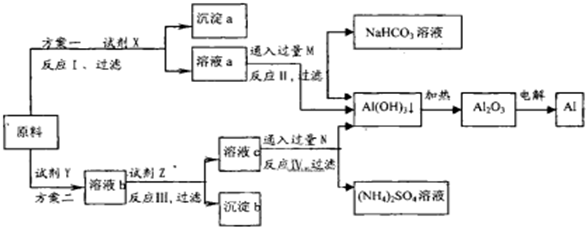
(1)试剂X的化学式为______,反应I的离子方程式是______.
实验室配制480mL?1mol?L-1?X的溶液必须用到玻璃仪器除烧杯、玻璃棒、试剂瓶、胶头滴管外,还有______.常用来可以标定所配X的溶液浓度是否准确的实验名称是______.
(2)按照方案设计,试剂Z的作用是调节溶液的pH,以生成沉淀b[Fe(OH)3].从实际工业的角度,你认为方案______更合理,理由是______
(3)已知N为氨气,实验室中还可以用下图装置制取氨气并进行氨气喷泉实验.
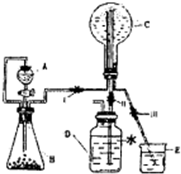
①仪器A的名称是______,装置中A口部和B口部之间联通导气管的作用是______
②若用此装置制备N气,若A中盛有浓氨水,则B装置中的固体试剂不可以选用下列的______(填字母序号).
A.生石灰?B.烧碱?C.胆矾?D.碱石灰
(4)若D中事先滴入少量酚酞,则C中液体呈______色,用离子方程式解释原因______.
参考答案:(1)方案一:由溶液a通入过量的M生成氢氧化铝沉淀、碳酸氢钠可知,溶液a中含有偏铝酸根、气体M为二氧化碳,故试剂X为NaOH溶液,反应I为氧化铝与氢氧化钠溶液反应生成偏铝酸钠与水,离子方程式为:Al2O3+2OH-═2AlO2-+H2O,
实验室没有480mL容量瓶,应选择500mL容量瓶,配制500mL1mol?L-1?NaOH的溶液需要玻璃仪器有:烧杯、玻璃棒、试剂瓶、胶头滴管、500mL容量瓶,故缺少500mL容量瓶,
可以利用中和滴定方法以标定所配NaOH溶液浓度是否准确;
故答案为:NaOH;Al2O3+2OH-═2AlO2-+H2O;500mL容量瓶;中和滴定;
(2)方案二:由溶液c通入过量的N生成氢氧化铝沉淀、硫酸铵可知,溶液c中含有铝离子、N为氨气,故试剂Y为硫酸,溶液b中含有硫酸铝、硫酸铁,调节PH值,是铁离子转化为氢氧化铁,过滤后,再向滤液中加入过量的氨水沉淀铝离子,
与方案一相比较,方案一步骤少,操作简单,故方案一更合理,
故答案为:方案一;步骤少,操作简单;
(3)①、仪器A是分液漏斗,装置中A口部和B口部之间联通导气管的作用是:平衡分液漏斗内外压强,防止分液漏斗堵塞;
②、A中盛有浓氨水,与生石灰、烧碱、碱石灰混合,放出大量的热,溶液中氢氧根离子浓度增大,利用氨气逸出,产生大量的氨气,氨水与胆矾反应生成氢氧化铜沉淀,不能产生氨气,故C不能可以,
故答案为:C;
(4)氨气溶于水,反应生成一水合氨,一水合氨电离出氢氧根,NH3+H2O?NH3?H2O?NH4++OH-,溶液呈碱性,酚酞在碱性条件下呈红色,
故答案为:红;NH3+H2O?NH3?H2O?NH4++OH-.
本题解析:
本题难度:一般
2、选择题 (13分)某研究性学习小组的同学利用下图来验证某铜银合金完全溶解于浓硝酸时生成的气体除NO2外还含有NO,并测定合金中铜的质量分数。已知常温下NO2和N2O4混合存在,在低于0℃时几乎只有无色的N2O4晶体。
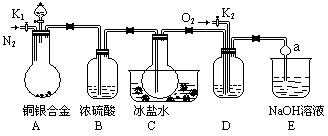
(1)写出A中铜与硝酸反应的一个化学方程式_________________________________
(2)反应前先打开A部分的活塞K1,持续通入一段时间的N2,理由是_________________
若装置中缺少B部分,会影响验证的结果,其原因是___________________________
(3)反应结束后,打开活塞K2,并通入O2,若有NO产生,则D产生的现象是________
_______________________
(4)实验测得的数据如下:合金质量15.0g,13.5mol/LHNO340mL;实验后A溶液:V=40mL,c(H+)=1.0mol/L,假设反应中硝酸无挥发也没有分解。则反应中消耗的HNO3物质的量为_____mol;
(5)利用A装置中反应后溶液也可确定铜的质量分数,方法是取出A中的反应的溶液,向其中加入足量的_____溶液,然后进行的操作的步骤分别是______________。
参考答案:(1)Cu+4HNO3(浓)=Cu(NO3)3+2NO2↑+2H2O或
3Cu+8HNO3(稀)=3Cu(NO3)3+4H2O+2NO↑
(2)排除装置中的空气,防止干扰验证性实验;部分NO2与水作用生成NO干扰验证性实验(3)有红棕色气体生成(4)0.5(5)盐酸(1分,其它合理也可以);过滤、洗涤、干燥、称量
本题解析:略
本题难度:简单
3、选择题 在硫酸铁溶液中,加入a g铜,完全溶解后,又加入b g铁,充分反应后得到c g残余固体,且b<c,则下列判断正确的是? ( )
A.最后得到的溶液中含有Fe3+
B.残余固体可能为铁、铜混合物
C.最后得到的溶液中只含Cu2+
D.残余固体一定全部是铜
参考答案:B
本题解析:本题涉及的反应有:(1)Cu+2Fe3+==Cu2++2Fe2+,(2)Fe+Cu2+==Fe2++Cu,所以C不正确;由于题目中b<c,说明所加的Fe的量不确定,若Fe的量不足,说明Cu没有被全部置换出来,Cu2+ 没有完全反应掉,故残留固体全部为Cu;若Fe过量,且符合b<c,则残余固体可能为铁、铜混合物,所以B正确,D不正确;因为Fe3+能够氧化Cu,所以当残留固体中有Cu存在时,溶液中一定不含有Fe3+,所以A不正确。故选B。
点评:本题主要考查铁及其化合物的知识,要求会判断反应物与产物,题目难度中等。
本题难度:简单
4、选择题 工业上以CuO和H2SO4为原料制备CuSO4·5H2O晶体。为确保制备过程中既不补充
水,也无多余的水分,所用硫酸溶液溶质的质量分数应为
A.45.8%
B.57.6%
C.72.3%
D.无法确定
参考答案:B
本题解析:本题考查计算能力,试题难度中等;根据题意,制备过程中既不补充水,也无多余的水分,故CuSO4·5H2O中的水来自反应生成的水和硫酸溶液中的水,1molCuSO4·5H2O中含有5mol结晶水,其中有1mol来自CuO和H2SO4反应,故硫酸溶液中的水为4mol,所以硫酸溶液的质量分数为:×100%=57.6%
本题难度:一般
5、填空题 (10分)向硫酸亚铁溶液中滴加氢氧化钠溶液,实验的现象是:有?色沉淀产生,迅速变为?色,?最后变为?色。有关的化学方程式为:
1)?2)?
参考答案:白?灰绿?红褐
1)FeSO4 + 2NaOH ="=" Fe(OH)2↓ + Na2SO4
2)4Fe(OH)2 + O2 + 2H2O ="=" 4Fe(OH)3
本题解析:考查Fe(OH)2的制取及性质
制取:FeSO4 + 2NaOH ="=" Fe(OH)2↓ + Na2SO4
Fe(OH)2易被氧化,颜色由白色迅速转化为灰绿色,最终为红褐色的Fe(OH)3:4Fe(OH)2 + O2 + 2H2O ="=" 4Fe(OH)3
本题难度:一般