1、填空题 运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2(g)+3H2(g)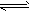 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡
________移动(填“向左”、“向右”或“不”);使用催化剂________反应的△H(填“增大”、“减小”或“不改变”)。
(2)已知:
O2(g) = O2+(g)+e- △H1=1175.7 kJ·mol-1
PtF6(g)+e-=PtF6-(g) △H2=-771.1 kJ·mol-1
O2PtF6(s)=O2+(g)+PtF6-(g) △H3=482.2 kJ·mol-1
则反应O2(g)+PtF6(g) = O2+PtF6-(s)的△H=_____________ kJ·mol-1。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为______________________________。已知25℃时
Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应时溶液中c(NH4+)=c(Cl-)。则溶液显____性(填“酸”、“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=________。
参考答案:(1)向左;不改变
(2)-77.6
(3)Cu(OH)2;Cu2++2NH3·H2O==Cu(OH)2↓+2NH4+
(4)“略”
本题解析:
本题难度:一般
2、简答题 常温下,浓度均为0.1mol/L的四种溶液:①Na2CO3溶液?②NaHCO3溶液?③盐酸?④氨水
试回答下列问题:
(1)上述溶液中有水解反应发生的是______(填编号,下同),溶液中溶质存在电离平衡的是______;
(2)比较①、②溶液,pH值较大的是______;
(3)在溶液④中加入少量NH4Cl固体,此时C(NH4+)/C(OH-)的值将______(填“变小”、“变大”或“不变”);
(4)用溶液③滴定V?mL溶液④其滴定曲线如图所示:
①试分析在滴定过程中,滴定曲线上a、b、c、d四点,水的电离程度最大的是______点,理由是______;
②a点溶液中离子浓度大小关系是______;
③取少量c点溶液于试管,再滴加0.1mol/L?NaOH溶液至中性.此时溶液中除H+、OH-外,离子浓度大小关系是______.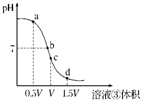
参考答案:(1)能水解的是盐溶液中的弱离子的性质,溶质存在电离平衡的是弱电解质或弱酸酸式酸根离子;①Na2CO3溶液是强碱弱酸盐,碳酸根离子水解; ②NaHCO3溶液强碱弱酸盐,碳酸氢根离子水解;碳酸氢根离子存在电离平衡;③盐酸 是强酸;④氨水 是弱碱存在电离平衡,故答案为:①②;②④;
(2)同浓度的:①Na2CO3溶液 ②NaHCO3溶液 碳酸钠水解程度大于碳酸氢钠;溶液的pH①>②,故答案为:①;
(3)氨水中一水合氨是弱电解质,存在电离平衡,加入氯化铵,铵根离子抑制电离,平衡逆向进行,氢氧根离子浓度减小,铵根离子浓度增大;此时C(NH4+)/C(OH-)的值将增大,
故答案为:变大;
(4)①用溶液③盐酸滴定V mL溶液④氨水,溶液PH随反应进行减小,到恰好完全反应生成氯化铵溶液时,铵根离子水解显酸性,此时促进水的电离;依据0.1mol/L的氨水溶液Vml和0.1mol/L的盐酸溶液恰好反应需要溶液体积为Vml,确定c点是恰好反应;酸过量或碱碱过量对水的电离起到抑制作用,
故答案为:c;恰好完全反应生成氯化铵溶液时,铵根离子水解显酸性,促进水的电离,酸过量或碱碱过量对水的电离起到抑制作用;
②a点反应情况是:0.1mol/L的氨水溶液Vml和0.1mol/L的盐酸溶液0.5VL反应,溶液中为同浓度的氯化铵和一水合氨的混合溶液;依据一水合氨电离大于铵根离子的水解分析判断溶液中的离子浓度为:c(NH4+)>c(Cl-)>c(OH-)>c(H+),故答案为:c(NH4+)>c(Cl-)>c(OH-)>c(H+);
③取少量c点NH4Cl溶液于试管,再滴加0.1mol/L NaOH溶液至中性.此时溶液中除H+、OH-外,离子浓度大小关系可以依据溶液中电荷守恒得到c(H+)+c(NH4+)+c(Na+)=c(OH-)+c(Cl-);溶液中除H+、OH-外存在的离子浓度关系为:c(NH4+)+c(Na+)=c(Cl-),故答案为:c(NH4+)+c(Na+)=c(Cl-).
本题解析:
本题难度:一般
3、选择题 冰醋酸加水稀释时,溶液中的氢离子浓度随加入的水量变化的下列各曲线图中,正确的是 ( )
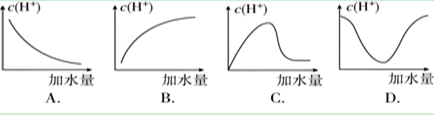
参考答案:C
本题解析:在浓醋酸中,“促进电离,增大氢离子浓度”起主要作用,氢离子浓度就增大,在稀醋酸中,“水的稀释减小氢离子浓度”起主要作用,氢离子浓度就减小,所以在整个稀释过程中,氢离子的物质的量一直是增大的,但氢离子浓度是先增大后减小,故选C。
考点:弱电解质的电离平衡
本题难度:一般
4、选择题 50℃时,下列各溶液中,离子的物质的量浓度关系正确的是
A pH=4的醋酸中:c(H+)=4.0molL-1
B 饱和小苏打溶液中:c(Na+)= c(HCO3-)
C 饱和食盐水中:c(Na+)+ c(H+)= c(Cl-)+c(OH-)
D pH=12的纯碱溶液中:c(OH-)=1.0×10-2molL-1
参考答案:D
本题解析:A中c(H+)=10-4mol/L,不是4mol/L,A错;HCO3-+H2O H2CO3-+OH-、HCO3-
H2CO3-+OH-、HCO3- CO32-+H+,根据钠元素与碳元素间的关系得,c(Na+)=c(HCO3-)+(H2CO3)+c(CO32-),B错。根据饱和食盐水中离子的种类及电荷守恒关系知,C正确。25℃时,pH=12的纯碱溶液中,c(OH-)=10-2mol/L,所以D错。答案选C。
CO32-+H+,根据钠元素与碳元素间的关系得,c(Na+)=c(HCO3-)+(H2CO3)+c(CO32-),B错。根据饱和食盐水中离子的种类及电荷守恒关系知,C正确。25℃时,pH=12的纯碱溶液中,c(OH-)=10-2mol/L,所以D错。答案选C。
本题难度:一般
5、选择题 在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH-离子浓度分别为Amol·L-1与Bmol·L-1,则A和B的关系为
A.A>B
B.A=10-4B
C.B=10-4A
D.A=B