|
高中化学知识点讲解《磷及其化合物》考点预测(2017年强化版)(八)
2017-11-05 22:34:39
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、填空题 (16分)氯化铵是一种重要的化工原料,应用广泛。
(1)实验室通常用NH4Cl固体与Ca(OH)2固体混合共热制取氨气。
①写出实验室制取氨气的反应方程式? ?。
②浓氨水可以用来检验有毒气体氯气的泄漏,反应式为3Cl2 +8NH3= N2 + 6NH4Cl,在该反应中,氧化剂是 (填化学式),检测时观察到的现象是? ?,21.3 g氯气能氧化氨气?mol。
(2)用浓氯化铵溶液处理的舞台幕布难着火,其原因是?(填字母)。
①幕布的着火点升高
②幕布的质量增加
③氯化铵分解吸收热量,降低了温度
④氯化铵分解产生的气体隔离了部分空气
A.①②
B.③④
C.①③
D.②④
| (3)实验室可用NH4Cl溶液与饱和的NaNO2溶液反应制取纯净的氮气,反应方程式为:
NaNO2+NH4Cl 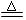 ?NaCl+N2↑+2H2O ?NaCl+N2↑+2H2O
实验装置如下图所示,试回答:
①装置中A部分的分液漏斗与蒸馏烧瓶之间连接
的导管所起的作用是?(填写编号)。
a.防止饱和溶液蒸发
b.保证实验装置不漏气
c.使饱和NaNO2溶液容易滴下
②加热前必须进行的一个操作步骤是? ?。
③收集N2最适宜的方法是?(填写编号)
a.排空气法收集在集气瓶中
b.排水法收集在集气瓶中
c.直接收集在球胆或塑料袋中
参考答案:(每空2分,16分)
(1)2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O; Cl2; 有大量白烟产生; 0.2 CaCl2+2NH3↑+2H2O; Cl2; 有大量白烟产生; 0.2
(2)B
(3)c; 检查气密性; c
本题解析:略
本题难度:一般
2、选择题 将5.6 g Fe投入浓硝酸溶液,产生红棕色气体A,把所得溶液减压蒸干,得到20g Fe(NO3)2和Fe(NO3)3的混合物,将该固体在高温下加热,得到红褐色的Fe2O3和气体B,A、B气体混合通入水中,剩余气体的体积为(?)mL
A.1120? B. 2240?C.360? D.4480
参考答案:B
本题解析:略
本题难度:简单
3、选择题 欲迅速除去铝壶底部的水垢〔主要成分:CaCO3和Mg(OH)2〕,最好的办法是用(?)
A.浓盐酸
B.稀硝酸
C.浓硫酸
D.浓硝酸
参考答案:D
本题解析:浓硝酸既可以使Al钝化,又可与CaCO3反应。
本题难度:简单
4、实验题 (共10分)已知氨可以与灼热的氧化铜反应得到氮气和金属铜,反应方程式为2NH3+3CuO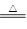 N2+3H2O+3Cu,用示意图中的装置可以实现该反应。回答下列问题: N2+3H2O+3Cu,用示意图中的装置可以实现该反应。回答下列问题:
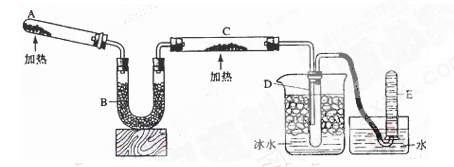
(1)A中发生反应的化学方程式是?。检验氨气通常采用的方法及现象是_________?______,?。
(2)B中加入的物质是?,其作用是?。
(3)实验时C中观察到的现象是?,该反应中氨的作用是_______剂。
(4)若要检验反应生成的水,可将试管D及烧杯部分改成两个相连的干燥管,第一个干燥管X内装有_____________,现象是___________________;第二个干燥管Y内装有碱石灰,作用是____________________________。
参考答案:(1)2NH4Cl+Ca(OH)2 2NH3↑+CaCl2+2H2O (1分) 2NH3↑+CaCl2+2H2O (1分)
用湿润的红色石蕊试纸(1分),试纸变蓝(1分)
(2)碱石灰,(1分)除去氨水中的水蒸汽(1分)
(3)黑色固体逐渐变成红色(1分),还原(1分)
(4)无水硫酸铜(1分),变蓝(1分)
防止E中的水蒸汽进入干燥管x,影响水的检验。(1分)
本题解析:(1)A中是制取氨气的,所以方程式为2NH4Cl+Ca(OH)2 2NH3↑+CaCl2+2H2O。氨气溶于水显碱性,和氯化氢反应冒白烟,据此可以检验。 2NH3↑+CaCl2+2H2O。氨气溶于水显碱性,和氯化氢反应冒白烟,据此可以检验。
(2)和氧化铜反应的氨气应该是干燥的,所以B中用碱石灰除去氨气中的水蒸气。
(3)氨气具有还原性,在加热的条件下,能还原氧化铜,生成铜、氮气和水,所以现象是黑色固体逐渐变成红色。
(4)检验水蒸气常用无水硫酸铜,遇水即变成蓝色。用于装置E中水蒸气可能进入干燥管。影响水的检验,所以作用就是防止E中的水蒸汽进入干燥管x,影响水的检验。
本题难度:一般
5、填空题 (9分)某校研究性学习小组的同学学习完氮的有关物质的性质之后,对氮元素的氢化物NH3性质的探究。
(1)实验室制取氨气的化学方程式为?。
(2)某同学模仿排饱和食盐水收集氯气的方法,想用排饱和氯化铵溶液的方法收集氨气。你认为他能否达到目的??(填“能”或“否”),理由是?。
(3)该小组的同学设计了如图所示的实验装置(夹持及尾气处理装置未画出),探究氨气的还原性。
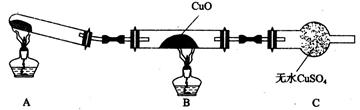
①该装置在设计上有一定缺陷。为保证实验结果的准确性,对该装置的改进措施是
?。
②利用改进后的装置进行实验,CuO变为红色物质,无水CuSO4变蓝,同时生成一种无污染的气体。氨气与CuO反应的化学方程式为?。
③有同学认为NH3与CuO反应生成的红色物质中可能含Cu2O。Cu2O在酸性溶液中Cu+歧化生成Cu和Cu2+。请设计一个简单的实验检验该红色物质中是否含有Cu2O?
?。
参考答案:(1)2NH4Cl+Ca(OH)2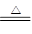 CaCl2+2NH3↑+2H2O(2分) CaCl2+2NH3↑+2H2O(2分)
(2)否(1分)?氨气极易溶于水、氯化铵对氨气在水中的溶解影响不大(1分)
(3)①在装置A与B之间增加装有碱石灰的干燥管(1分)
②3CuO+2NH3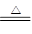 3Cu+N2+3H2O(2分) 3Cu+N2+3H2O(2分)
③取少许样品,加入稀H2SO4,若溶液出现蓝色,说明含有Cu2O,反之则没有(2分)
本题解析:(1)实验室制取氨气的化学方程式为2NH4Cl+Ca(OH)2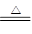 CaCl2+2NH3↑+2H2O。 CaCl2+2NH3↑+2H2O。
(2)由于氨气极易溶于水、氯化铵对氨气在水中的溶解影响不大,所以不能用排饱和氯化铵溶液的方法收集氨气。
(3)①由于生成的氨气中含有水蒸气,从而干扰实验的验证,所以需要在装置A与B之间增加装有碱石灰的干燥管来干燥氨气。
②根据原子守恒可知,没有污染的气体应该是氮气,所以反应的化学方程式是3CuO+2NH3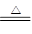 3Cu+N2+3H2O。 3Cu+N2+3H2O。
③根据题意可知,Cu2O在酸性溶液中Cu+歧化生成Cu和Cu2+而使溶液显蓝色,据此可以验证,但该酸不能是氧化性酸,所以可以用盐酸或稀硫酸。因此正确的操作是:取少许样品,加入稀H2SO4,若溶液出现蓝色,说明含有Cu2O,反之则没有。
点评:化学是一门以实验为基础的学科,所以有化学实验即科学探究之说法。这些探究性和制备性实验的试题,综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。
本题难度:一般
| 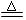 ?NaCl+N2↑+2H2O
?NaCl+N2↑+2H2O