1、填空题 (10分)下图所示反应I、反应II和反应III均是工业生产中常见的反应。其中A、B为化合物,C是温室气体之一,D和K均可用做干燥剂,H常温下为液态化合物,J是一种具有漂白作用的盐,反应III和E与G反应的原理相同。
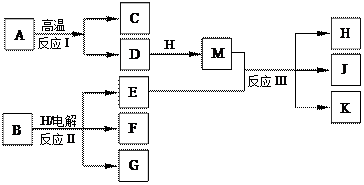
(1)C与J的水溶液反应后生成的含氧酸的电子式是?。
(2) E与G反应的离子方程式是?。
E与G反应的离子方程式是?。
(3)J久置后,即便不接触水、空气,本身也逐渐分解生成K,并放出气体,该反应的化学方程式是?。
(4)工业上测定反应III产品的有效成分J的含量,先将一定量的产品的溶液加入过量的KI溶液和稀硫酸中,使之反应生成I2,然后用Na2S2O3标准溶液滴定I2,计算出结果。
①用Na2S2O3标准溶液滴定I2时选用的指示剂是?。
②生成I2的反应的离子方程式是?。
参考答案:(10分,每空2分)
(1)
 ?
?
(2)Cl2 + 2OH- ?Cl-+ ClO-+ H2O
?Cl-+ ClO-+ H2O
(3)Ca(ClO)2 ="=" CaCl2 +O2↑
(4)①淀粉溶液?② ClO-+ 2I-+2H+=Cl-+ I2 + H2O
ClO-+ 2I-+2H+=Cl-+ I2 + H2O
本题解析:略
本题难度:一般
2、选择题 卤族元素及其化合物与社会、生活关系密切。下列有关说法不正确的是(?)
A.加碘食盐中加入的是碘酸钾
B.常用于杀菌消毒的84消毒液的成分是液氯
C.可用硝酸银溶液来鉴别纯净水和自来水
D.变色眼镜和照相器材的生产都要用到溴化银
参考答案:B
本题解析:加碘食盐中加入的是碘酸钾,A正确;84消毒液的有效成分是NaClO溶液,B错;自来水一般是用氯气来消毒的,其中含有Cl-,与AgNO3溶液反应生成AgCl白色沉淀,C正确;溴化银具有感光性,常用于变色眼镜和照相器材的生产,D正确。
本题难度:一般
3、选择题 下列叙述中,不正确的是( )
A.氯气能溶解于水
B.氯气是一种有毒气体
C.氯气、液氯和氯水是同一种物质
D.氯气是一种黄绿色、有刺激性气味的气体
E.氯气是一种黄绿色、有刺激性气味的气体
参考答案:A.常温下,1体积水中能溶解2体积氯气,故A正确;
B.氯气是具有强氧化性、腐蚀性的极毒性气体,吸入人体,会出现以急性呼吸系统损害为主的全身性疾病,故B正确;
C.液氯是氯气的液态形式,是单质,而氯水是氯气的水溶液,是混合物,故C错误;
D.氯气在常温下为气态,颜色为黄绿色,有刺激性,故D正确;
故选C.
本题解析:
本题难度:一般
4、填空题 浩瀚的海洋是一个巨大的宝库,蕴含有80多种元素,可供提取利用的有50多种。
(1)其中“氯碱工业”就是以食盐水为原料制取Cl2等物质,有关的化学方程式为:?。
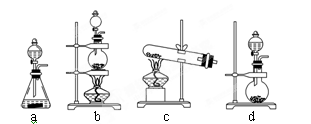
(2)实验室用二氧化锰制取氯气的化学方程式为:?;根据上述实验原理,从下列装置中选择合适的发生装置用于实验室制取少量氯气?(填写装置的序号)。
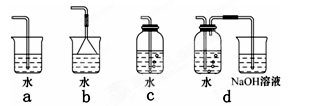
(3)实验室中模拟Br—→Br2的转化,可以通过在KBr溶液中滴加少量新制氯水的实验进行实现。写出Br—→Br2的转化离子方程式为:?;氯水不稳定,要现用现配,下列吸收氯气制备氯水的装置最合理的是?(选填下列选项的编号字母)。
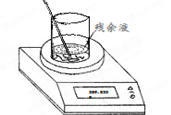
(4)实验室制备氯气的反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学进行了以下实验:取100 mL残余液放入烧杯中,将烧杯(含玻璃棒)放在电子天平上(如右图),再把已称好50.0 g CaCO3粉末慢慢加入到残余液中,边加边搅拌使其充分反应。观察读数变化如下表所示:
CaCO3用量
| 未加CaCO3时
| 加约四分之一时
| 加一半时
| 全部加完时
|
读数/g
| 318.3
| 325.3
| 334.5
| 359.5
|
请你据此分析计算:
①实验中产生的CO2气体质量为?;
②残余液中盐酸的物质的量浓度为 (结果精确到小数点后一位)?。
参考答案:(1)2NaCl+2H2O 2NaOH+H2↑+Cl2↑(2分)
2NaOH+H2↑+Cl2↑(2分)
(2)MnO2+4HCl(浓)  MnCl2+2H2O+Cl2↑(2分);b(1分)
MnCl2+2H2O+Cl2↑(2分);b(1分)
(3)2Br-+Cl2=2Cl-+Br2(2分);d(1分) (4)①8.8g(2分);②4.0mol/L(3分)
本题解析:(1)“氯碱工业”是以食盐水为原料,通过电解法制取Cl2等物质,有关的化学方程式为2NaCl+2H2O 2NaOH+H2↑+Cl2↑。
2NaOH+H2↑+Cl2↑。
(2)实验室用二氧化锰制取氯气的化学方程式为MnO2+4HCl(浓)  MnCl2+2H2O+Cl2↑。根据方程式可知该反应是固体与液体加热制备气体,因此需要的主要仪器是酒精灯、分液漏斗、烧瓶,则实验装置应该是装置b,即答案选b。
MnCl2+2H2O+Cl2↑。根据方程式可知该反应是固体与液体加热制备气体,因此需要的主要仪器是酒精灯、分液漏斗、烧瓶,则实验装置应该是装置b,即答案选b。
(3)氯气的氧化性强于单质溴的,能把溴离子氧化生成单质溴,所以Br—→Br2的转化离子方程式为2Br-+Cl2=2Cl-+Br2。氯气能溶于水,但溶解度很小。另外氯气有毒,需要尾气处理,可以用氢氧化钠溶液吸收,因此正确的答案选d。
(4)①根据质量守恒定律可知,反应中产生CO2的质量=318.3g+50.0g-359.5g=8.8g。
②CO2的物质的量=8.8g÷44g/mol=0.2mol,则根据方程式可知
CaCO3+2HCl=CaCl2+H2O+CO2↑
2mol? 1mol
0.4mol? 0.2mol
所以盐酸的浓度=0.4mol÷0.1L=4.0mol/L
本题难度:一般
5、选择题 下列事实能用同一原理解释的是( )
A.Cl2与Fe、Cu反应生成高价氯化物
B.NH4HCO3晶体、固体I2受热均能变成气体
C.SO2、Cl2均能使品红溶液褪色
D.ClO-与Fe2+、H+均不能大量共存
参考答案:A、氯气具有强氧化性,与金属反应生成最高价态氯化物,故A正确;
B、NH4HCO3晶体分解,固体I2受热升华,前者是化学变化,后者是物理变化,故B错误;
C、SO2能使品红溶液褪色是由于和有色有机物反应生成无色不稳定的物质,由于Cl2和水反应生成具有强氧化性和漂白性的HClO,则Cl2使品红溶液褪色,二者漂白的原理不一样,故C错误;
D、HClO既具有氧化性,又具有弱酸性,ClO-将Fe2+氧化成Fe3+,与H+均反应生成弱电解质HClO,反应原理不同,故D错误;
故选A.
本题解析:
本题难度:简单