1、选择题 下列化合物中,含有非极性键的离子化合物是
A.Ba(OH)2
B.H2SO4
C.Na2O2
D.CaCl2
参考答案:C
本题解析:A错,Ba(OH)2为含有极性键的离子化合物;B错,硫酸为共价化合物,不是离子化合物;C正确,Na2O2含有非极性键的离子化合物;D错,CaCl2只含有离子键无共价键的离子化合物;
本题难度:一般
2、选择题 金属钠晶体为体心立方晶格(如下图),实验测得钠的密度为ρ(g·cm-3)。已知钠的相对原子质量为a,阿伏加德罗常数为NA(mol-1),假定钠原子为等径的刚性球且处于体对角线上的三个球相切。则钠原子的半径r(cm)为
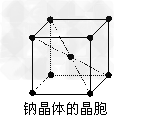
[? ]
A.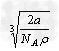
B.
C.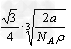
C.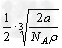
参考答案:C
本题解析:
本题难度:一般
3、选择题 下列晶体中,熔点最高的是(?)
A.KF
B.MgO
C.CaO
D.NaCl
参考答案:B
本题解析:四种物质形成的晶体均是离子晶体,离子晶体中离子键越强,物质的熔点越高,形成离子键的离子的离子半径越小,所带电荷数越多,离子键越强,熔点越高。阴离子比较大小顺序为O2->F->Cl-,阳离子大小顺序为K+>Ca2+>Na+>Mg2+,所以答案是B。
本题难度:一般
4、选择题 如图所示晶体结构是一种具有优良的压电、铁电、电光等功能的晶体材料的最小结构单元(晶胞)。晶体内与每个“Ti”紧邻的氧原子数目和这种晶体材料的化学式分别是(各元素所带电荷均已略去)

[? ]
A.8;BaTi8O12
B.8;BaTi4O9
C.6;BaTiO3
D.3;BaTi2O3
参考答案:C
本题解析:
本题难度:一般
5、选择题 下列各组物质中,含有离子晶体、分子晶体、原子晶体各一种的是( ? )
A.KCl、H2SO4、S
B.金刚石、Na3PO4、Mg
C.NH4F、SiO2、Ar
D.H2O、干冰、SiO2
参考答案:C
本题解析:考查晶体类型的判断。通过离子键形成的晶体是离子晶体,通过分子间作用力形成的晶体是分子晶体。通过金属键形成的晶体是金属晶体。通过共价键形成的空间网状结构的晶体是原子晶体。所以A中分别是离子晶体、分子晶体、分子晶体。B中分别是原子晶体、离子晶体、金属晶体。C中分别随离子晶体、原子晶体、分子晶体。D中分别是分子晶体、分子晶体、原子晶体。因此答案是C。
本题难度:一般