|
|
|
高中化学知识点归纳《盐类水解的原理》考点特训(2017年冲刺版)(八)
2017-11-05 22:49:28
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、填空题 (10分)(1)常温下,向20 mL 0.2 mol·L-1H2A溶液中滴加0.2 mol·L-1NaOH溶液。有关微粒物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。请根据图示填空:

①当V(NaOH)=20mL时,溶液中离子浓度的大小关系: ___________________;
②等体积、等物质的量浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水_________(填“大”、“小”或“相等”),欲使NaHA溶液呈中性,可以向其中加入___________。
(2)氨气分解反应的热化学方程式如下:2NH3(g) N2(g)+3H2(g) △H=+92.4kJ·mol-1研究表明金属催化剂可加速氨气的分解。图1为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率。 N2(g)+3H2(g) △H=+92.4kJ·mol-1研究表明金属催化剂可加速氨气的分解。图1为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率。
①不同催化剂存在下,氨气分解反应的活化能最大的是__________(填写催化剂的化学式)。
②恒温(T1)恒容时,用Ni催化分解初始浓度为c0的氨气,并实时监测分解过程中氨气的浓度。计算后得氨气的转化率α(NH3)随时间t变化的关系曲线(见图2)。请在图2中画出:如果将反应温度提高到T2,Ru催化分解初始浓度为c0的氨气过程中α(NH3)—t的总趋势曲线(标注Ru—T2)
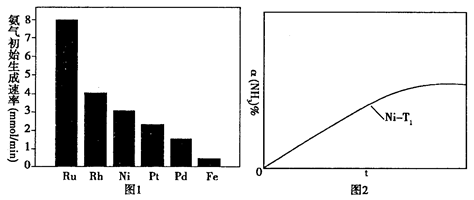
③假设Ru催化下温度为T1时氨气分解的平衡转化率为40%,则该温度下此分解反应的平衡常数K与c0的关系式是:K=_____________。
参考答案:(10分)(1)①C(Na+)>C(HA-)>C(H+)>C(A2-)>C(OH-) (2分)②小;(1分)碱(其他合理答案均可)(2分)(2)① Fe (1分) ②见图曲线 Ru-T2  (2分) (2分)
③ 0.12c02(2分)
本题解析:(10分)(1)①当氢氧化钠的体积为20毫升时,反应只生成NaHA,根据图像,溶液显酸性,电离大于水解,所以离子浓度关系为C(Na+)>C(HA-)>C(H+)>C(A2-)>C(OH-);②当二者等浓度等体积混合时,溶质为NaHA,溶液显酸性,电离大于水解,所以抑制水的电离,水的电离程度比纯水的小;要使溶液显中性,需要加入碱或碱性物质。(2)①氨气分解反应的活化能最大的说明反应速率最慢,从图分析,使用Fe做催化剂时反应最慢。②如果将反应温度提高到T2,Ru催化分解,反应速率加快,先达到平衡,氨气的由于温度升高,促进分解,氨气的分解转化增大,所以曲线为:

③氨气分解的平衡转化率为40%,则分解的氨气的浓度为c0*40%,生成氮气的浓度为c0*40%/2,氢气的浓度为c0*40%*3/2,则平衡常数为(c0×40%/2)(c0×40%×3/2)3/c0-c0×40%)2=0.12c02。
考点:酸碱混合后溶液酸碱性的判断,催化剂对反应速率和平衡的影响,化学平衡常数的计算
本题难度:困难
2、选择题 为了使硫化钠溶液中的c(Na+)≈2c(S2-),应该对硫化钠溶液采取的措施是
A.加入少量盐酸
B.加入少量氢氧化钾
C.加入少量氯化铜
D.升高温度
参考答案:B
本题解析:
本题难度:一般
3、选择题 下列溶液中各微粒的浓度关系不正确的是
A.0.1 mol/L的HCOOH溶液中:c(HCOO—)+c(OH—)=c(H+)
B.1 L 0.1 mol/L的CuSO4·(NH4)2SO4·6H2O的溶液中: c(SO42—)>c(NH4+)>c(Cu2+)>c(H+)>c (OH—)
C.0.1 mol/L 的NaHCO3溶液中: c(Na+)+c(H+)=c(HCO3—)+2c(CO32—)+c(OH—)
D.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:
| c(Na+)>c(HX)>c(X—)>c(H+)>c(OH—)
参考答案:D
本题解析:A、根据电荷守恒可知,0.1 mol/L的HCOOH溶液中:c(HCOO—)+c(OH—)=c(H+),A正确;B、铜离子和铵根离子均水解,溶液显酸性,所以1 L 0.1 mol/L的CuSO4·(NH4)2SO4·6H2O的溶液中: c(SO42—)>c(NH4+)>c(Cu2+)>c(H+)>c (OH—),B正确;C、根据电荷守恒可知0.1 mol/L 的NaHCO3溶液中: c(Na+)+c(H+)=c(HCO3—)+2c(CO32—)+c(OH—),C正确;D、根据电荷守恒可知,在等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中存在c(Na+)+ c(H+)=c(X—)+c(OH—),所以不可能存在c(Na+)>c(HX)>c(X—)>c(H+)>c(OH—),D错误,答案选D。
考点:考查溶液中离子浓度大小比较
本题难度:困难
4、选择题 将0.1mol/L的下列物质的水溶液从常温加热到80℃,溶液的pH值不变的是
A.CH3COOH
B.H2SO4
C.NH4Cl
D.NaOH
|
参考答案:B
本题解析:加热时,弱电解质的电离程度增大,水电离程度及盐的水解程度增大、Kw也增大,A、C、中溶液的pH变小;D.碱溶液的pH取决于碱电离出的c(OH-)的大小,c(H+)=Kw/c(OH-),pH变小;
B.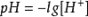 ,无论温度高低,氢离子的浓度不变,PH不变,选B。
,无论温度高低,氢离子的浓度不变,PH不变,选B。
考点:考查溶液的PH。
本题难度:一般
5、选择题 蒸干FeCl3水溶液后再加强热,得到的固体物质主要是( )
A.FeCl3
B.FeCl3·6H2O
C.Fe(OH)3
D.Fe2O3
参考答案:D
本题解析:FeCl3在水中发生水解:FeCl3+3H2O Fe(OH)3+3HCl,加热促进水解,由于HCl具有挥发性,会从溶液中挥发出去,从而使FeCl3彻底水解生成Fe(OH)3,Fe(OH)3为不溶性碱,受热易分解,最终生成Fe2O3。
Fe(OH)3+3HCl,加热促进水解,由于HCl具有挥发性,会从溶液中挥发出去,从而使FeCl3彻底水解生成Fe(OH)3,Fe(OH)3为不溶性碱,受热易分解,最终生成Fe2O3。
本题难度:一般
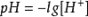 ,无论温度高低,氢离子的浓度不变,PH不变,选B。
,无论温度高低,氢离子的浓度不变,PH不变,选B。 Fe(OH)3+3HCl,加热促进水解,由于HCl具有挥发性,会从溶液中挥发出去,从而使FeCl3彻底水解生成Fe(OH)3,Fe(OH)3为不溶性碱,受热易分解,最终生成Fe2O3。
Fe(OH)3+3HCl,加热促进水解,由于HCl具有挥发性,会从溶液中挥发出去,从而使FeCl3彻底水解生成Fe(OH)3,Fe(OH)3为不溶性碱,受热易分解,最终生成Fe2O3。