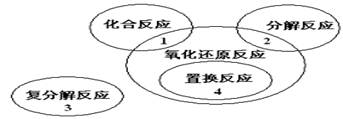
1、选择题 氧化还原反应与四种基本类型反应的关系如右图所示,则下列化学反应属于3区的是(?)。
A.Cl2+2KBr===Br2+2KCl
B.HCl + NaOH====NaCl+H2O
C.4Fe(OH)2+O2+2H2O===4Fe(OH)3
D.2Na2O2+2CO2===2Na2CO3+O2
参考答案:B
本题解析:由图可知3区为复分解反应,且一定不是氧化还原反应,而A中氯元素、C中铁元素、D中—1价氧元素化合价均有变化是氧化还原反应,答案选B。
本题难度:简单
2、填空题 现有溶质质量分数为98%、密度为1.84kg·L-1的浓硫酸,若用其配制1.0mol·L-1的稀硫酸250ml。回答下列问题:
(1)需要98%的浓硫酸??ml(计算保留两位小数)。
(2)配制时,要用到的玻璃仪器除量筒、烧杯、玻璃棒外,还需??。
参考答案:(1)13.6
(2)250 ml容量瓶,胶头滴管
本题解析:溶液在稀释前后溶质的物质的量不变。(1.84×103g/L×V×98%)÷98g/mol=0.25L×1.0mol/L.解得V="0.0136L=13.6ml." (2)在配制物质的量浓度的溶液时,要用到的玻璃仪器除量筒、烧杯、玻璃棒、胶头滴管、250 ml容量瓶。
本题难度:简单
3、选择题 在一定条件下,1体积气体A2和3体积B2完全反应生成了2体积气体X(体积在相同条件下测定),则X的化学式是( )
A.AB
B.A2B2
C.AB2
D.AB3
参考答案:D
本题解析:
本题难度:一般
4、简答题 4.35g二氧化锰能与浓盐酸(密度为1.19g?cm-3、质量分数为36.5%)完全反应.求:
(1)盐酸中HCl的物质的量浓度.
(2)被氧化的HCl的物质的量.
(3)将所得气体全部用石灰乳吸收,可得到漂白粉的质量.
参考答案:(1)密度为1.19g?cm-3、质量分数为36.5%浓盐酸的物质的量浓度为1000×1.19×36.5%36.5mol/L=11.9mol/L,
答:盐酸中HCl的物质的量浓度为11.9mol/L;
(2)4.35g二氧化锰的物质的量为4.35g87g/mol=0.05mol,则:
MnO2+4HCl═MnCl2+Cl2↑+2H2O
?1? ? 1
0.05mol? n(Cl2)?
故n(Cl2)=0.05mol
被氧化的HCl生成Cl2,根据氯原子守恒可知,被氧化的HCl的物质的量是Cl2的2倍,
故被氧化的HCl为0.05mol×2=0.1mol,
答:被氧化的HCl的物质的量是0.1mol;
(3)n(Cl2)=0.05mol,用石灰乳吸收,则:
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
2? 1? 1
0.05mol?n(CaCl2)? ?n[Ca(ClO)2]
所以n(CaCl2)=n[Ca(ClO)2]=0.05mol×12=0.025mol,
故可得漂白粉的质量为:0.025mol×111g/mol+0.025mol×143g/mol=6.35g,
答:氯气全部用石灰乳吸收,可得到漂白粉的质量为6.35g.
本题解析:
本题难度:一般
5、选择题 下列化学用语错误的是(?)
A.氯化氢分子的电子式:
B.乙烯的结构简式:CH2=CH2
C.苯的分子式:C6H6
D.氯的原子结构示意图: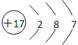
参考答案:A
本题解析:氯化氢属于共价化合物,电子式中不能出现离子,正确的电子式为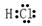 ,A错误,其他选项都正确。答案选A。
,A错误,其他选项都正确。答案选A。
点评:这类题基础,但是在高考中出现的几率高。
本题难度:简单