| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学试题《铁的氧化物》考点特训(2017年冲刺版)(十)
(7)通过实验所得数据,计算固体样品中FeCl3和FeCl2的物质的量之比为________________。 (8)可以采用下列装置制取少量的FeCl3固体,已知FeCl3易潮解。(部分夹持仪器已略去) 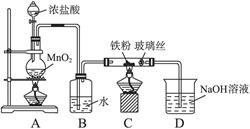 该装置存在不足,往往无法得到FeCl3固体,请你对装置提出合理的改进措施。___________。 参考答案:(1)烧杯、玻璃棒 本题解析:(2)为了防止FeCl2溶液水解、氧化应加入稀盐酸、铁粉;(4)做此种类型的题时,首先要明确沉淀以上所含杂质,此题中的杂质是Na+、Cl-,检验沉淀是否洗涤干净,只要检验洗涤后的溶液中是否含有Na+、Cl-中的一种就可以。(5)因为FeCl3易水解,且HCl易挥发,加热促进了FeCl3水解及HCl的挥发,所以不能得到FeCl3固体。(6)悬浮在水中的花粉小颗粒也能做布朗运动。向胶体中加入少量的酸、碱、盐,会中和胶体所带的电荷,使胶体发生聚沉,所以向Fe(OH)3胶体中滴加硫酸,会先出现红褐色Fe(OH)3沉淀,但过量的硫酸还会和Fe(OH)3沉淀发生反应生成硫酸铁。CuSO4属于重金属盐,使蛋白质变性。(7)是有关混合物的计算,设FeCl3为x mol,FeCl2为y mol, 本题难度:一般 4、实验题 (16分)某研究性学习小组在用CO还原Fe2O3的实验中,用磁铁吸出生成的黑色粉末X,他们认为X不一定是Fe,因温度不同、受热不均时会生成Fe3O4且也能被磁铁吸引。为探究X的组成,他们进行了如下实验。
(2)实验①中可能发生反应的离子方程是??,?,?。 Ⅱ.定量测定 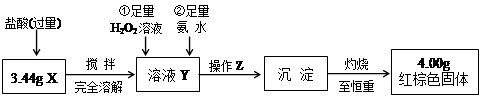 (3)操作Z是?。在灼烧沉淀时必须用到的下列仪器的名称是____________________________。  (4)通过以上数据,得出3.44g黑色粉末X中各成分的物质的量为:______、______。 参考答案:(1)否(2分)?(2)Fe3O4 + 8H+ ="==" Fe2+?+ 2Fe3+ + 4H2O;(2分) 本题解析:(1)由于在单质铁的存在下,铁离子是不可能存在的,所以不能确定是否含有四氧化三铁。 本题难度:一般 5、实验题 (4分)右图是铁粉和水蒸气反应的实验装置示意图 参考答案:(4分) 本题解析: 本题难度:一般 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点归纳《溶液的性质.. | |