1、选择题 某元素R有两种同位素,可分别表示为85R和87R,若R的近似相对原子质量为85.5则85R原子的质量分数为
A.75%
B.25%
C.74.6%
D.64.7%
参考答案:C
本题解析:元素的近似相对原子质量=(各元素原子的质量数×同位素在自然界中的质量分数)之来源:91考试网 91ExAm.org和;
设85R原子的质量分数为x,则85×x+87×(1—x)=85.5;得x=74.6%
本题难度:一般
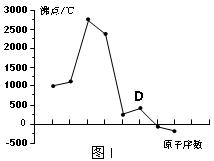
2、填空题 (8分)原子序数依次增大的A、B、C、D四种短周期元素。元素A的原子半径在短周期中最小,元素C的单质在空气中含量最多,D所在周期的各元素单质沸点变化如图I(原子序数按递增顺序连续排列)。B、C、D三种元素均能与A形成等电子的三种分子,且化合物中各原子的个数比为:
化合物
| 甲
| 乙
| 丙
|
原子个数比
| B∶A=1∶3
| C∶A=1∶2
| D∶A=1∶2
|
?
(1)元素D在元素周期中的位置?。
(2)B、C形成的一种化合物X是一种原子晶体,晶体中B、C原子均达到稳定结构,则X的化学式为?;X的熔点?金刚石(填“大于”、“等于”或“小于”)。
(3)写出图I中沸点最高的单质与NaOH溶液反应的离子方程式?。
参考答案:(8分,每空2分)⑴第三周期第VIA族;⑵C3N4、大于;⑶2Al+2OH-+2H2O=2AlO2-+3H2↑
本题解析:略
本题难度:简单
3、填空题 在1—18号元素中,某元素R最外层电子数与电子层数相同,则R元素可能是(写元素符号)__________________。
参考答案:H、Be、Al
本题解析:解决本题有两种方法,一种方法是写出1—18号原子的原子结构示意图,从中逐一辨认,找出符合要求的元素,显然这种方法不可取;另一种方法是把握题设特点,从以下三个方面试写:
①R有1个电子层且最外层有1个电子的: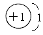 ,H元素。
,H元素。
②R有2个电子层且最外层有2个电子的: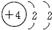 ,Be元素。
,Be元素。
③R有3个电子层且最外层有3个电子的: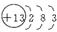 ,Al元素。
,Al元素。
由于R是1—18号元素中的,所以它不会有4个电子层。
本题难度:简单
4、选择题 下列有关元素周期表的说法中错误的是

A.氢处 于第一周期
于第一周期
B.氯处于VⅡA族

C.第二周期共有8种元素
D.第三周期元素全部是金属
参考答案:D
本题解析:略
本题难度:一般
5、填空题 (8分)氮元素可以形成多种化合物。
回答以下问题:
(1)基态氮原子的价电子排布式是 。
(2)C、N、O三种元素第一电离能从大到小的顺序是 。
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被——NH2(氨基)取代形成的另一种氮的氢化物。
①NH3分子的空间构型是 ;N2H4分子中氮原子轨道的杂化类型是 。
②肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g)△H=-1 038.7 kJ·mol-1
若该反应中有4 mol N-H键断裂,则形成的π键有 mol。
③肼能与硫酸反应生成N2H6SO4,N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在 (填标号)。
a.离子键 ? b.共价键
c.配位键?d.范德华力
参考答案:(1) 2s22p3?(2)? N>O>C?(3)①;三角锥形;sp3?② 3?③? D
本题解析:(1)根据构造原理可知,氮的价电子排布式为2s22p3。
(2)非金属性越强,第一电离能越大。由于氮原子的2p轨道单质是半充满状态,所以第一电离能大小顺序为N>O>C 。
(3)①氨气分子中中心原子氮原子含有1对孤对电子,所以是三角锥形结构。所以N2H4分子中氮原子轨道的杂化类型是sp3杂化。
②1分子肼中含有4个N-H键,所以反应中有4 mol N-H键断裂时,能生成1.5mol氮气。由于三键是由2个π键和1个δ键形成的,所以成的π键有1.5mol×2=3mol。
③硫酸铵中含有离子键、极性键和配位键,不存在范德华力,所以答案选D。
本题难度:一般