1、填空题 硫-碘循环分解水制氢主要涉及下列反应:
Ⅰ SO2+2H2O+I2=H2SO4+2HI
Ⅱ 2HI H2+I2
H2+I2
Ⅲ 2H2SO4=2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是_____________。
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程中产生1mol O2的同时产生1mol H2
(2)一定温度下,向1L密闭容器中加入1mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。
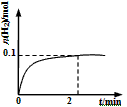
0~2 min内的平均反应速率v(HI) =___________。该温度下,H2(g)+I2(g) 2HI(g)的平衡常数K=_____________。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则________是原来的2倍。
2HI(g)的平衡常数K=_____________。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则________是原来的2倍。
a.平衡常数 b.HI的平衡浓度 c.达到平衡的时间 d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡__________移动(填“向左” “向右”或者“不”);若加入少量下列试剂中的______________,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.CH3COONa d.NaHSO3
2、选择题 人体血液内的血红蛋白( Hb)易与O2结合生成HbO2,因此具有输氧能力。CO吸入肺中发生反应:CO+ HbO2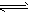 O2+HbCO,37℃时,该反应的平衡常数K=220。 HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是
O2+HbCO,37℃时,该反应的平衡常数K=220。 HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是
[? ]
A.CO与HbO2,反应的平衡常数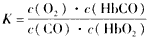
B.人体吸入的CO越多,与血红蛋白结合的O2越少
C.当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损
D.把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动
3、选择题 可逆反应2A+B?2C(g)△H<0,随温度变化气体平均相对分子质量如图所示,则下列叙述正确的是( )
A.A和B可能都是固体
B.A和B一定都是气体
C.A和B可能都是液体
D.若B为固体,则A一定是气体
