|
高考化学必考知识点《未知》答题技巧(2017年最新版)(十)
2017-11-05 23:00:59
来源:91考试网
作者:www.91exam.org 【 大 中 小】
4CuI+Hg===Cu2HgI4+2Cu。
(1)上述反应产物Cu2HgI4中,Cu元素是________价。
(2) CuI可由Cu2+与I-直接反应制得,请配平下列反应的离子方程式:
 Cu2++ Cu2++ I-=== I-=== CuI+ CuI+ I I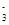
参考答案:Ⅰ(1)NaNO2 0.75 (2)②⑤
(3)② (4)D (4)D
Ⅱ.(1)+1 (2) 2Cu2++5I-===2CuI+I3-
本题解析:Ⅰ(1)根据反应的方程式可知,亚硝酸钠中氮元素的化合价从+3价降低到+2价,得到1个电子,所以亚硝酸钠是还原剂。HI中I元素的化合价从-1价升高到0价,失去1个电子,则根据电子得失守恒可知,若有0.75 mol的还原剂被氧化,则被还原的氧化剂有0.75mol。
(2)根据反应的方程式可知,该反应是在酸性条件下进行的,所以必须选用的物质有淀粉碘化钾试纸和食醋,答案选②⑤。
(3)使NaNO2转化为不引起二次污染的N2,这说明在反应中亚硝酸钠是氧化剂,得到电子,所以选择的应该是还原剂,NH4+中的氮元素处于最低价态,具有还原性,所以选择的试剂是氯化铵,即答案选②,反应的方程式是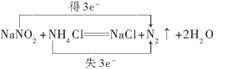 。 。
(4)A中的OH-与NH4+不能大量共存;B中溶液显酸性,则NO3-能氧化Fe2+不能大量共存;C中的CH3COO-和H+不能大量共存,所以答案选D。
Ⅱ.(1)在Cu2HgI4中,Hg显+2价,I是-1价,所以铜是+1价。
(2)在反应中铜的化合价从+2价降低到+1价,得到1个电子,而碘元素碘化合价从-1价升高到0价,失去1个电子,则根据电子的得失守恒可知,配平后的方程式应该是2Cu2++5I-===2CuI+I3-。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,在注重对学生基础知识巩固和训练的同时,侧重对学生解题能力的培养和方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和发散思维能力。该题的关键是准确标出有关元素的化合价变化情况,然后依据有关的概念,并结合电子得失守恒进行列式计算和判断即可。
本题难度:一般
2、填空题 (7分)工业尾气SO2、NO2是污染大气、形成酸雨的罪魁祸首。请回答下列问题:
(1)用CO可以消除SO2污染。已知一定条件下,2CO(g)+O2(g)==2CO2(g)的能量变化如图所示,由固体S单质生成l molSO2(g)的焓变为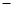 296kJ·mol 296kJ·mol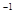 。 。
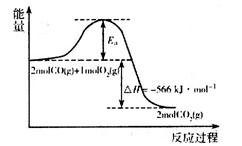
在相同条件下,CO与SO2反应生成单质S与CO2的热化学方程式为___________________________。
(2)异氰酸(化学式:HNCO,C为+4价)可用于消除尾气中的NO2。其反应原理为:
HNCO+NO2→N2+CO2+ (未配平)。 (未配平)。
①上述反应的氧化剂是____________。
②配平后方框内应填写____________。
③每处理33.6LNO2(标准状况),反应中转移电子的物质的量为____________。
参考答案:(1)2CO(g)+SO2(g)=S(s)+2CO2(g) △H=-270kJ/mol (2)NO2;4H2O;6mol
本题解析:(1)根据能量变化关系图可知反应的热化学方程式为① 2CO(g)+O2(g)==2CO2(g) △H=-566kJ/mol。又因为固体S单质生成l molSO2(g)的焓变为 296kJ/mol,则该反应的热化学方程式为②S(s)+O2(g)==SO2(g) △H=-296kJ/mol,则根据盖斯定律可知①-②即得到2CO(g)+SO2(g)=S(s)+2CO2(g) △H=-270kJ/mol; 296kJ/mol,则该反应的热化学方程式为②S(s)+O2(g)==SO2(g) △H=-296kJ/mol,则根据盖斯定律可知①-②即得到2CO(g)+SO2(g)=S(s)+2CO2(g) △H=-270kJ/mol;
(2)①HNCO中C为+4价,则氮元素是-3价。根据方程式可知,反应后NO2中氮元素由+4价降低到0价,得到4个电子,NO2是氧化剂。HNCO中氮元素由-3价升高到0价,失去3个电子,作还原剂,所以根据电子得失守恒可知氧化剂与还原剂的物质的量之比是3:4。根据原子守恒可知还有水生成,因此配平的化学方程式为8HNCO+6NO2=7N2+CO2+4H2O。
②根据以上分析可知,配平后方框内应填写4H2O。
③33.6L标准状况下NO2的物质的量是33.6L÷22.4L/mol=1.5mol,反应中得到1.5mol×4=6mol电子。
考点:考查盖斯定律的应用以及氧化还原反应的有关判断、配平与计算
本题难度:一般
3、填空题 已知下列变化过程中,有一个RxO72-;离子反应时,反应就转移6个电子;____RxO72-+____Fe2++____
H+→____R3++____Fe3++____H2O
(1)x值为____。
(2)配平上述离子方程式(直接在括号内写出)。
(3)发生还原反应的是____;还原产物是____。
参考答案:(1)2
(2)RxO72-+6Fe2++14H+=2R3++6Fe3++7H2O
(3)RxO72-;R3+
本题解析:
本题难度:一般
4、选择题 有Fe2+、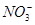 、Fe3+、 、Fe3+、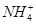 、H+和H2O六种粒子,属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是 、H+和H2O六种粒子,属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是
A.氧化剂和还原剂的物质的量之比为1∶8
B.该反应说明Fe(NO3)2溶液不宜加酸酸化
C.每1 mol 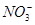 发生氧化反应,转移8 mol e- 发生氧化反应,转移8 mol e-
D.若把该反应设计为原电池,则负极反应为Fe2+-e-=Fe3+
参考答案:C
本题解析:酸性条件下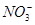 具有强氧化性,Fe3+也具有氧化性,故应是 具有强氧化性,Fe3+也具有氧化性,故应是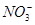 将Fe2+氧化为Fe3+,该反应的离子方程式为8Fe2++ 将Fe2+氧化为Fe3+,该反应的离子方程式为8Fe2++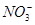 +10H+=8Fe3++ +10H+=8Fe3++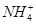 +3H2O,B项正确;氧化剂与还原剂的物质的量之比为1∶8,A项正确; +3H2O,B项正确;氧化剂与还原剂的物质的量之比为1∶8,A项正确;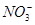 中氮的化合价为+5价, 中氮的化合价为+5价,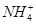 中氮的化合价为-3,故1 mol 中氮的化合价为-3,故1 mol 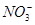 发生了还原反应,C项错误;原电池的负极发生氧化反应,D项正确。 发生了还原反应,C项错误;原电池的负极发生氧化反应,D项正确。
本题难度:一般
5、选择题 在化学分析中草酸(H2C2O4)是重要的还原剂,已知20.00 mL 0.100 mol·L-1 VO2+离子恰好将20.00 mL? 0.050 mol·L-1 H2C2O4完全氧化成CO2,VO2+被还原为VOn+离子,则VOn+中的n值为
A.1
B.2
C.3
D.4
参考答案:B
本题解析:VO2+与H2C2O4的物质的量比为2:1,即:2VO2+ + 1H2C2O4→2VOn+ + 2CO2,反应中有2个电子的转移,V由+5价降至+4价,得n=2
本题难度:一般
|  Cu2++
Cu2++ I-===
I-=== CuI+
CuI+ I
I