1、简答题 (10分)(1)向用氯化铁溶液刻制印刷电路后的废液中,加入足量铁粉,发生反应的离子方程式是?、?。
(2)实验室向某溶液中加入硫氰化钾溶液,无现象,滴加少量氯水,立即变为红色,则原溶液中含有(填离子符号)?,写出滴加氯水时发生反应的离子方程式?。
(3)我们知道,浓硫酸有脱水性、吸水性和氧化性,请写出证明浓硫酸具有氧化性的反应的化学方程式(写一个,多写若有一个错误,本题不得分)?。
参考答案:(1)2Fe3++Fe=3Fe2+? Cu2++Fe=Cu+Fe2+
(2)Fe2+? 2Fe2++Cl2=2Fe3++2Cl-
(3)Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O或C+2H2SO4(浓)
CuSO4+SO2↑+2H2O或C+2H2SO4(浓) CO2↑+2SO2↑+2H2O(其它答案合理也给分)
CO2↑+2SO2↑+2H2O(其它答案合理也给分)
本题解析:氯化铁溶液刻制印刷电路后的废液中,有Fe3+和Cu2+,因此,加入足量铁粉,2Fe3++Fe=3Fe2+? Cu2++Fe=Cu+Fe2+(2)向某溶液中加入硫氰化钾溶液,无现象,说明没有Fe3+,滴加少量氯水,立即变为红色,说明有Fe2+,2Fe2++Cl2=2Fe3++2Cl-(3)浓硫酸具有氧化性,可以和不活泼金属反应,也可以和碳单质反应,方程见答案。
本题难度:一般
2、填空题 已知下列变化过程中,有一个RxO72-;离子反应时,反应就转移6个电子;____RxO72-+____Fe2++____
H+→____R3++____Fe3++____H2O
(1)x值为____。
(2)配平上述离子方程式(直接在括号内写出)。
(3)发生还原反应的是____;还原产物是____。
参考答案:(1)2
(2)RxO72-+6Fe2++14H+=2R3++6Fe3++7H2O
(3)RxO72-;R3+
本题解析:
本题难度:一般
3、填空题 (8分)(1)请将5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
(1) +  + + +H2O
+ + +H2O
(2)反应物中发生氧化反应的物质 ,被还原的元素是 。
(3)反应中1 mol氧化剂得到 mol电子。
参考答案:(8分) (1)FeSO4+HNO3 Fe(NO3)3+Fe2(SO4)3+N2O+H2O(2分)
Fe(NO3)3+Fe2(SO4)3+N2O+H2O(2分)
(2)FeSO4 N (各2分) (3)4 (2分)
本题解析:(1)所给的物质组合中,HNO3中氮元素化合价位于最高价,具有氧化性,对应还原产物为NO2,能将还原性的FeSO4氧化为Fe2(SO4)3,根据氢原子守恒,水在生成物中,可得:FeSO4+HNO3 Fe(NO3)3+Fe2(SO4)3+N2O+H2O。
Fe(NO3)3+Fe2(SO4)3+N2O+H2O。
(2)还原剂FeSO4发生氧化反应,化合价降低的N元素被还原。
(3)反应中N元素化合价由+5价降低到+1价,则1mol氧化剂得到4mol电子。
考点:本题考查氧化还原反应原理。
本题难度:一般
4、填空题 过氧化钙晶体[CaO2·8H2O]较稳定,呈白色,微溶于水,能溶于酸性溶液。广泛应用于环境杀菌、消毒等领域。
★过氧化钙晶体的制备
工业上生产CaO2·8H2O的主要流程如下:
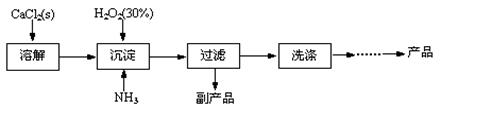
(1)用上述方法制取CaO2·8H2O的化学方程式是?。
(2)沉淀时常用冰水控制温度在10℃以下和通入过量的NH3,其可能原因分别是
①?;②?。
★过氧化钙晶体含量的测定
准确称取0.3000g产品于锥形瓶中,加入30 mL蒸馏水和10 mL 2.000 mol·L-1 H2SO4,用0.0200mol·L—1 KMnO4标准溶液滴定至终点。重复上述操作两次。H2O2和KMnO4反应的离子方程式为2MnO4-+5 H2O2+6H+=2Mn2++5O2↑+8H2O
(3)滴定终点观察到的现象为?。
(4)根据表1数据计算产品中CaO2·8H2O的质量分数(写出计算过程):
滴定次数
| 样品的质量/g
| KMnO4溶液的体积/mL
|
滴定前刻度/mL
| 滴定后刻度/mL
|
1
| 0.3000
| 1.02
| 24.04
|
2
| 0.3000
| 2.00
| 25.03
|
3
| 0.3000
| 0.20
| 23.24
|
?
表1. KMnO4标准溶液滴定数据
参考答案:(1)CaCl2+H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH4Cl;(2)①温度低可减少过氧化氢的分解,提高过氧化氢的利用率(或防止过氧化氢的分解);②通入过量的NH3使溶液呈碱性,抑制CaO2·8H2O的溶解(或提高产品的产率);(3)当滴入最后一滴KMnO4标准溶液后由无色变浅红色,且半分钟内不褪色。(4)82.91%? 5 CaO2·8H2O?~?5 H2O?~? 2 KMnO4
n(CaO2·8H2O)=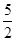 n(KMnO4)=
n(KMnO4)= 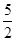 ×0.0200mol/L×23.03mL×10-3L/mL=1.1151×10-3mol,所以CaO2·8H2O的质量分数为:
×0.0200mol/L×23.03mL×10-3L/mL=1.1151×10-3mol,所以CaO2·8H2O的质量分数为: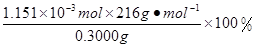 =82.91%
=82.91%
本题解析:(1)根据题意可知:用上述方法制取CaO2·8H2O的化学方程式是CaCl2+H2O2+2NH3+ 8H2O= CaO2·8H2O↓+2NH4Cl。(2)沉淀时常用冰水控制温度在10℃以下和通入过量的NH3是因为①温度低可减少过氧化氢的分解,提高过氧化氢的利用率;②通入过量的NH3使溶液呈碱性,抑制CaO2·8H2O的溶解(或提高产品的产率)。(3)CaO2+2H2O=Ca(OH)2+H2O2; 2MnO4-+5 H2O2+6H+=2Mn2++5O2↑+8H2O.当达到滴定终点时会观察到溶液由无色变为浅红色,半分钟内不褪色。(4)由方程式得关系式为:5CaO2·8H2O ~2KMnO4。消耗的KMnO4溶液的体积为{(24.04-1.02)+( 25.03-2.00)+( 23.24-0.20)}ml÷3=23.03ml.n(CaO2·8H2O)=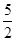 n(KMnO4)=
n(KMnO4)= 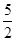 ×0.0200mol/L×23.03mL ×10-3L/mL ="1.1151" ×10-3mol 。所以CaO2·8H2O的质量分数为:
×0.0200mol/L×23.03mL ×10-3L/mL ="1.1151" ×10-3mol 。所以CaO2·8H2O的质量分数为: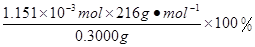 =82.91%。2·8H2O的制备原理及操作注意问题、滴定终点的判断、物质含量的测定的知识。
=82.91%。2·8H2O的制备原理及操作注意问题、滴定终点的判断、物质含量的测定的知识。
本题难度:一般
5、简答题 现有短周期元素组成的A、B、C、D、E五种物质,存在如下转化关系(部分产物已略去),其中E为黑色粉末,D为无色气体.
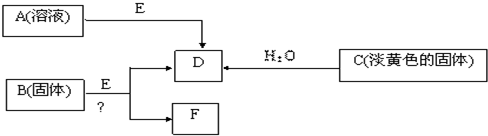
(1)若B为含氯元素的钾盐,与浓盐酸反应可以生成黄绿色气体,且1mol?B转移5mol?电子,则B与浓盐酸反应的化学方程式为______.?生成的氧化产物与还原产物的物质的量之比为______;
(2)将F从混合物中分离出来的实验操作步骤为______、______、______.由A制得2mol?D时,转移电子数为______?mol
(3)电解F的饱和水溶液得到碱溶液M,写出该反应的离子方程式;______,若将浓度为?c?mol?L-1?的M溶液与0.2mol?L-1?的一元酸HA等体积混合,所得溶液pH=7.溶液中离子浓度的大小关系为______?(浓度用C表示).
(4)固体C与FeCl3溶液按物质的量为2:1反应的离子方程式______;
将Fe(OH)3和NaOH与NaClO混合作用后,是制得緑色水处理剂(Na2FeO4)的一种方法,请完成下列方程式:
______Fe(OH)3+______NaOH+______NaClO=______Na2FeO4+______NaCl+______H2O.
参考答案:短周期元素组成的A、B、C、D、E五种物质,C是淡黄色固体,与水反应生成无色气体D,故C为Na2O2,D为O2,E为黑色粉末,由A溶液E
本题解析:
本题难度:一般