1、填空题 (11分)(1)在标准状况下,将?L NH3溶于水得到0.5 L 0.5 mol·L-1的氨水;配制100 mL 0.1mol·L-1 CuSO4溶液,需要CuSO4·5H2O于?g。取出5 mL该溶液,它的物质的量浓度为?,该100 mL溶液可以跟浓度为0.1 mol·L-1?的NaOH溶液?mL完全反应。
(2)在H、O、H+、H2、OH-、H2O六种微粒中,保持氢气化学性质的微粒是(填化学式,下同)?;电解水时变化的最小微粒是?;水变成水蒸气时?没有变化;带电的微粒是?;质子数多于核外电子数的微粒是?。
(3)有相同状况下的两种气体12C18O和14N2。若两种气体的质量相等,则12C18O和14N2气体所含质子数之比为?;若两种气体的分子数相同,则12C18O和14N2的体积之比为?。
参考答案:
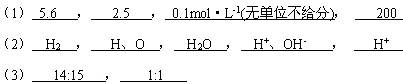
本题解析:略
本题难度:一般
2、选择题 铜有两种常见的氧化物CuO和Cu2O。某学习小组取0.98g(用精密天平测量)Cu(OH)2固体加热,有铜的氧化物生成,其质量随温度变化如图1所示:另外,某同学绘制了三条表示金属氧化物与其所含金属元素的质量的关系曲线,如图2所示。则下列分析正确的是
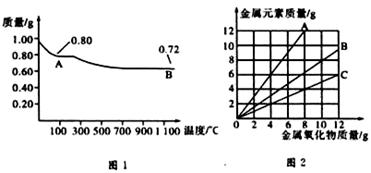
A.图1中,A到B的过程中有0.01 mol电子发生了转移
B.图1整个过程中共生成0.26 g水
C.图2三条曲线中,表示CuO和其中所含Cu元素质量关系的曲线是A
D.图1中A和B化学式分别为Cu2O和CuO
参考答案:A
本题解析:由0.98 gCu(OH)2可知其物质的量为0.01 mol,若全部生成CuO,则质量为0.01 mol×80 g?mol-1=0.8g,所以A点是CuO;若全部生成Cu2O,则质量为0.005 mol×144 g?mol-1=0.72g,所以B点是Cu2O,即D不正确;A到B的反应是氧化铜分解生成氧化亚铜和氧气,根据化学方程式Cu(OH)2 CuO+H2O、4CuO
CuO+H2O、4CuO 2Cu2O+O2↑可知,0.26 g是水和氧气的质量和,故B错误;CuO和其中所含Cu元素的质量关系(以CuO的质量为10g计算)为: CuO~Cu
2Cu2O+O2↑可知,0.26 g是水和氧气的质量和,故B错误;CuO和其中所含Cu元素的质量关系(以CuO的质量为10g计算)为: CuO~Cu
80? 64
10g? 8g
观察图2可知,B曲线符合上述质量关系,表示的是CuO,而A点上的任何一点都表示金属氧化物的质量小于其中所含金属元素的质量,故C错误;氧化铜的物质的量是0.01mol,则根据反应式4CuO 2Cu2O+O2↑可知,A到B的过程中有0.01 mol电子发生了转移,故A正确,答案选A。
2Cu2O+O2↑可知,A到B的过程中有0.01 mol电子发生了转移,故A正确,答案选A。
本题难度:一般
3、计算题 (6分)利用“化学计量在实验中的应用”的相关知识进行填空
(1)含有6.02×1023个氧原子的H2SO4的物质的量是_________
参考答案:
本题解析:
本题难度:一般
4、填空题 (4分)1mol Na2SO4的质量为?克,含有?个氧原子,其水溶液的电离方程式为?。
参考答案:142g , 2.408×1024,? Na2SO4=2Na++SO42-
本题解析:略
本题难度:简单
5、选择题 CuO、Cu2O的混合物中含Cu 88%,则混合物中含CuO和Cu2O的物质的量之比为()
A.1∶5
B.3∶2
C.1∶4
D.5∶1