1、选择题 用98%的浓H2SO4(密度1.84g/cm3)配制1:4(一体积浓硫酸和四体积水混合)的稀硫酸(密度1.225g/cm3),若用a表示所得硫酸溶液物质的量浓度,用b%表示其溶质质量分数,则下列各式中正确的是( )
A.b%=
×100%
B.b%=×100%
C.a=mol/L
D.a=mol/L
参考答案:A、令浓硫酸体积为1mL,则水的体积为m4L,则稀硫酸的质量为1ml×1.84g/cm3+4ml×1g/ml=(1.84+4)g
溶质硫酸的质量为1ml×1.84g/cm3×98%=1×1.84×98%g,所以稀硫酸的质量分数b%=1×1.84×98%g(1.84+4)g×100%=1×1.84×98%1.84+4×100%,故A正确;
B、稀硫酸体积不等于浓硫酸与水的体积之和,故B错误;
C、稀硫酸体积不等于浓硫酸与水的体积之和,故C错误;
D、令浓硫酸体积为1L,则水的体积为4L,则稀硫酸的质量为1000ml×1.84g/cm3+4000ml×1g/ml=1000×(1.84+4)g,所以稀硫酸的体积为1000×(1.84+4)g1.225g/ml=1000×(1.84+4)1.225ml=(1.84+4)1.225L,所以稀硫酸的物质的量浓度a=1000ml×1.84g/ml×98%98g/mol1.84+41.225L=1.84×98%÷98(1.84+4)÷1225mol/L,故D正确.
故选AD.
本题解析:
本题难度:一般
2、计算题 (6分)标准状况下的H2和CO的混合气体总体积4.48L,其总质量为4.3g。
求:(1)混合气体的平均摩尔质量 g/mol;
?(2)混合气体所含质子的总物质的量 mol,
?(3)若该混合气体与氧气恰好完全反应,则消耗标准状况下O2?L.
参考答案:(6分)(1)平均摩尔质量 21.5 g/mol;
(2)总物质的量 2.2 mol;
(3)若标准状况下O2 2.24?L
本题解析:略
本题难度:一般
3、选择题 设NA代表阿伏加德罗常数(NA)的数值,下列说法正确的是
A.22.4 L Cl2中含有NA个C12分子
B.1 L 0.1 mol·L-1 Na2SO4溶液中有0.1 NA个Na+
C.1 mol H2与1 mol C12反应生成NA个HCl分子
D.1 mol Ca变成Ca2+时失去的电子数为2NA
参考答案:D
本题解析:A选项没有指出条件是否为标准状况;B选项中Na+ 的物质的量为0.2mol,因此Na+
的物质的量为0.2mol,因此Na+ 应为0.2NA个;C选项中H2和Cl2反应的化学方程式为H2+Cl2=2HCl,因此1 mol H2与1 mol C12反应生成2NA个HCl分子;D选项中Ca失电子的反应为Ca-2e-=Ca2+,因此1 mol Ca失去2NA个电子数变成Ca2+。所以D选项正确。
应为0.2NA个;C选项中H2和Cl2反应的化学方程式为H2+Cl2=2HCl,因此1 mol H2与1 mol C12反应生成2NA个HCl分子;D选项中Ca失电子的反应为Ca-2e-=Ca2+,因此1 mol Ca失去2NA个电子数变成Ca2+。所以D选项正确。
本题难度:一般
4、填空题 等质量的氧气(O2)和臭氧(O3),物质的量之比为?,所含氧原子的个数之比为?
参考答案:3:2?、? 1:1
本题解析:根据n=m/M可知在质量相等的条件下,物质的量和摩尔质量成反比,即二者的物质的量之比是48︰32=3︰2。由于都是由氧原子形成的单质,所以所含氧原子的个数之比为1︰1。
本题难度:一般
5、选择题 取等物质的量浓度的NaOH溶液两份A和B,每份10 mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1 mol·L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,下列叙述正确的是(?)
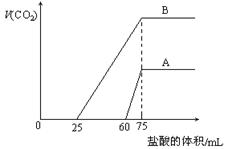
A.原NaOH溶液的物质的量浓度为0. 5mol/L
B.A线表明原NaOH溶液中通入CO2后,所得溶液中的溶质成分是Na2CO3,NaHCO3
C.B线中消耗盐酸0 < v(HCl) < 25mL时发生的离子反应为: OH-+H+=H2O? H++CO32-=HCO3-
D.B曲线表明原NaOH溶液中通入CO2后,所得溶液加盐酸后产生CO2气体体积(标准状况)的最大值为112mL
参考答案:D
本题解析:观察图象,B曲线不产生气体需要盐酸的体积少于产生气体需要盐酸的体积,B曲线为Na2CO3和NaHCO3混合溶液,A曲线不产生气体需要盐酸的体积多于产生气体需要盐酸的体积,A曲线为Na2CO3和NaOH混合溶液。B错误。
B线中消耗盐酸0 < v(HCl) < 25mL时发生的离子反应为:H++CO32-=HCO3-,C错误;
无论A曲线或B曲线,当加入盐酸75mL时,产生二氧化碳气体体积最大,此时恰好完全反应,溶液中溶质为NaCl,Na+来自氢氧化钠,Cl-来自盐酸,n(Na+)=n(Cl-)=n(NaOH)=0.0075mol,所以每份溶液中c(NaOH)=0.75mol/L,A错误;
设B曲线溶液中Na2CO3物质的量为xmol,NaHCO3物质的量为ymol,
0→25发生反应:CO32-+H+=HCO3-
x?x?x
25→75发生反应:HCO3-+H+=H2O+CO2↑
x+y?x+y
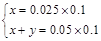 ?
?
n(CO2)=x+y=0.005mol,V(CO2)=112mL,D正确。
点评:氢氧化钠溶液中通入二氧化碳气体,按二氧化碳由少到多,所得溶液中溶质可能为:(1)NaOH+Na2CO3;(2)Na2CO3;(3)Na2CO3+NaHCO3;(4)NaHCO3。
本题难度:一般