1、选择题 检验氯化氢气体中是否混有氯气,可采用的方法是(?)
A.用干燥的蓝色石蕊试纸
B.用湿润的有色布条
C.将气体通入硝酸银溶液
D.将气体通入氢氧化钠溶液
参考答案:B
本题解析:略
本题难度:简单
2、选择题 下列过程中,涉及化学变化的是?
A.三氧化硫通入水中制硫酸
B.四氯化碳萃取碘水中的碘
C.分离水和四氯化碳
D.蒸馏法将海水淡化为饮用水
参考答案:A
本题解析:
正确答案:A
A.三氧化硫通入水中制硫酸:SO3+H2O=H2SO4;
B.四氯化碳萃取碘水中的碘,利用的是溶解性
C.分离水和四氯化碳,利用水与CCl4互不相溶
D.蒸馏法将海水淡化为饮用水,利用沸点不同
BCD都是利用物质的物理性质
本题难度:一般
3、选择题 已知Na2SO4和NaCl混合溶液中,Cl-的物质的量浓度是Na+的物质的量浓度的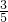 倍,下列叙述中正确的是
倍,下列叙述中正确的是
A.溶液中一定有1molNa2SO4和3molNaCl
B.所带电荷数SO42-是Na+的倍
C.SO42-与Cl-的物质的量之和等于Na+的物质的量
D.Na2SO4和NaCl的物质的量之比为1:3
参考答案:D
本题解析:分析:A、未给出溶液体积,无法得到具体的物质的量;
B、根据溶液呈电中性,阴阳离子所带电荷相等判断;
C、根据溶液呈电中性,阴阳离子所带电荷相等判断;
D、根据溶液呈电中性,阴阳离子所带电荷相等判断.
解答:A、未给出溶液体积,无法得到具体的物质的量,故A错误;
B、溶液呈电中性,由电荷守恒,所以2Q(SO42-)+Q(Cl-)=Q(Na+),由于Cl-的物质的量浓度是Na+的物质的量浓度的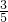 倍,所以Q(Cl-)=
倍,所以Q(Cl-)=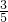 Q(Na+),使用Q(SO42-)=
Q(Na+),使用Q(SO42-)=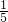 Q(Na+),故B错误;
Q(Na+),故B错误;
C、溶液呈电中性,阴阳离子所带电荷总数相等,所以2n(SO42-)+n(Cl-)=n(Na+),故C错误;
D、溶液呈电中性,阴阳离子所带电荷总数相等,所以2n(SO42-)+n(Cl-)=n(Na+),由于Cl-的物质的量浓度是Na+的物质的量浓度的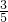 倍,所以n(Cl-)=
倍,所以n(Cl-)=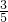 n(Na+),则n(SO42-)=
n(Na+),则n(SO42-)=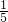 n(Na+),所以Na2SO4和NaCl的物质的量之比为1:3,故D正确.
n(Na+),所以Na2SO4和NaCl的物质的量之比为1:3,故D正确.
故选D.
点评:本题考查物质的量浓度的有关计算,难度不大,关键明白溶液呈电中性,阴阳离子所带电荷总数相等.
本题难度:一般
4、选择题 除去下列物质中所含少量杂质(括号内为杂质),所选试剂和分离方法能达到实验目的是(?)
?
| 混合物
| 试剂
| 分离方法
|
A
| 溴乙烷(溴)
| Na2SO3溶液
| 分液
|
B
| 甲苯(苯酚)
| 溴水
| 过滤
|
C
| 乙烷(乙烯)[
| H2
| /
|
D
| 乙酸乙酯(乙酸)
| NaOH溶液
| 分液
参考答案:A
本题解析:B项:苯酚与溴水生成的产物在甲苯中并不能形成沉淀;C:乙烯与氢气的条件不适宜在实验室条件下操作;D项:NaOH溶液会让乙酸乙酯发生碱性水解;故答案为A,溴化钾与亚硫酸钠溶液反应生成的产物溶于水层,与溴乙烷有机层进行分液即可。
本题难度:简单
5、选择题 下列每组各有三种物质,它们都不能用分液漏斗分离的是( )
A.乙酸乙酯和水,酒精和水,苯和水
B.二溴乙烷和水、溴苯和水、乙醛和水
C.硝基苯和苯、甲苯和苯、乙酸和乙醇
D.甘油和水、油脂和水,已烷和汽油
参考答案:C
本题解析:
本题难度:一般
|