1、选择题 将适量的SO2通过入Fe(NO3)3溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,继续滴入BaCl2溶液,产生白色沉淀.在上述一系列变化过程中,最终被还原的元素是( )
A.S
B.Fe
C.Cl
D.N
参考答案:将适量的SO2通过入Fe(NO3)3溶液中,溶液呈酸性,Fe3+具有氧化性,能将SO2氧化成硫酸,自身被还原为Fe2+,故溶液变为浅绿色;但立即又变为黄色,说明又被氧化为Fe3+,则可知溶液中的硝酸根离子在酸溶液中具有强氧化性,把亚铁离子氧化为三价铁离子,起氧化性的是硝酸,
故选D.
本题解析:
本题难度:简单
2、选择题 实验室常利用以下反应制取少量氮气:NaNO2+NH4C1═NaC1+N2↑+2H2O关于该反应的下列说法,正确的是( )
A.NaNO2是氧化剂
B.每生成1molN2时,转移电子的物质的量为6mol
C.NH4C1中的氮元素被还原
D.N2既是氧化剂,又是还原剂
参考答案:A、反应NaNO2+NH4C1═NaC1+N2↑+2H2O中,NaNO2中N的化合价从+3价降为0价,NaNO2是氧化剂,故A正确;
B、反应NaNO2+NH4C1═NaC1+N2↑+2H2O中,化合价升高值=化合价降低值=转移电子数=3,即每生成1molN2时,转移电子的物质的量为3mol,故B错误;
C、NH4C1中的氮元素化合价从-3价升为0价,所以NH4C1中的氮元素被氧化,故C错误;
D、反应NaNO2+NH4C1═NaC1+N2↑+2H2O中,NaNO2中N的化合价从+3价降为0价,NH4C1中的氮元素化合价从-3价升为0价,氮气既是氧化产物又是还原产物,故D错误.
故选A.
本题解析:
本题难度:简单
3、填空题 水在很多的反应中,起到极其重要的作用.根据下面水参与的反应,回答问题:
①2F2+2H2O═4HF+O2 ②2Na2O2+2H2O═4NaOH+O2↑
③2Na+2H2O═2NaOH+H2↑?④2H2O
2H2↑+O2↑
(1)水只作氧化剂的是______;(填写序号,下同)水只作还原剂的是______;水既作氧化剂,又做还原剂的是______;水既不是氧化剂,又不是还原剂的氧化还原反应是______.
(2)请标出下列反应的电子转移的方向和数目.
3Cl2+6NaOH=5NaCl+NaClO3+3H2O
(3)上述反应3Cl2+6NaOH=5NaCl+NaClO3+3H2O若转移5mol电子,则所得氧化产物的物质的量为______mol.
参考答案:(1)①该反应中,水中O元素失电子化合价升高,所以水中还原剂;
②该反应中水中的H和O元素的化合价都不变,所以水既不是氧化剂又不是还原剂;
③该反应中钠失电子化合价升高,水中氢元素得电子化合价降低,所以水作氧化剂;?
④该反应中,水中的H元素得电子化合价降低,水中的O元素失电子化合价升高,所以水既是氧化剂又是还原剂;
故答案为:③;①;④;②;
(2)反应3Cl2+6NaOH(热,浓)═5NaCl+NaClO3+H2O中,化合价升高的元素是Cl,化合价降低的元素也是氯元素,化合价升高数目=化合价降低数目=转移电子数目=5,电子转移的方向和数目如下所示:
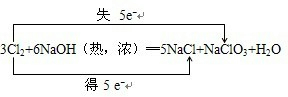
,
故答案为:

;
(3)该反应中的氧化产物是氯酸钠,氯酸钠和转移电子之间的关系式是1:5,所以若转移5mol电子,则所得氧化产物的物质的量为1mol,故答案为:1.
本题解析:
本题难度:一般
4、选择题 将SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:SO2+2Fe3++2H2O═SO42-+2Fe2++4H+,Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,有关说法正确的是( )
A.还原性Cr3+>Fe2+>SO2
B.氧化性Cr2O72->SO2>Fe3+
C.两个反应中Fe2(SO4)3均作还原剂
D.Cr2O72-能将Na2SO3氧化成Na2SO4
参考答案:A、反应SO2+2Fe3++2H2O═SO42-+2Fe2++4H+中,SO2做还原剂,Fe2+为还原产物,所以还原性:SO2>Fe2+,反应Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O中,Fe2+为还原剂,Cr3+为还原产物,所以还原性:Fe2+>Cr3+,故A错误;
B、反应SO2+2Fe3++2H2O═SO42-+2Fe2++4H+中,Fe3+做氧化剂,SO42-为氧化产物,SO2为还原剂,所以氧化性:Fe3+>SO42->SO2,反应Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O中,Cr2O72-为氧化剂,Fe3+为氧化产物,所以氧化性:Cr2O72->Fe3+,故B错误;
C、放应SO2+2Fe3++2H2O═SO42-+2Fe2++4H+中,铁元素化合价降低,为氧化剂,故C错误;
D、重铬酸根具有氧化性,能将亚铁离子氧化,也能将亚硫酸根氧化为硫酸根,故D正确.
故选D.
本题解析:
本题难度:简单
5、选择题 判断一个反应是否为氧化还原反应的标准是
[? ]
A.是否有氧元素参加反应
B.是否为置换反应
C.同一元素的化合价在反应前后是否发生变化
D.是否为化合反应或分解反应
参考答案:C
本题解析:
本题难度:简单