1、选择题 在一定温度下,向体积恒定为2L的密闭容器里充入2mol M和一定量的N,发生如下反应:M(g)+N(g) E(g);当反应进行到4min时达到平衡,测知M的浓度为0.2mol·L—1。下列说法正确的是?
E(g);当反应进行到4min时达到平衡,测知M的浓度为0.2mol·L—1。下列说法正确的是?
A.4min时,M的转化率为80%
B.4min时,用M表示这段时间内的反应速率为0.8mol·L—1·min—1
C.4min后,向容器中充入不参与反应的稀有气体,M的物质的量减小
D.2min时,M的物质的量浓度为0.6mol·L—1
2、选择题 对可逆反应A2(g)+B2(g) 2AB(g) 在一定条件下,达到平衡状态的标志是(?)
2AB(g) 在一定条件下,达到平衡状态的标志是(?)
A.单位时间内,生成n mol A2的同时,生成n mol的B2
B.单位时间内生成2n mol AB的同时,生成n mol的B2
C.平衡时容器内的总压强不随时间而变化
D.平衡时容器内各物质的物质的量比为1∶1∶2
3、填空题 (6 分)二甲醚是一种重要的清洁燃料,可以通过CH3OH分子间脱水制得:2CH3OH(g) CH3OCH3(g)+H2O(g)? ΔH=-23.5 kJ·mol-1。在T1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。
CH3OCH3(g)+H2O(g)? ΔH=-23.5 kJ·mol-1。在T1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。

(1)该条件下反应平衡常数表达式K=________。在T1℃时,反应的平衡常数为________;
(2)相同条件下,若改变起始浓度,某时刻各组分浓度依次为c(CH3OH)=0.4 mol·L-1,c(H2O)=0.6 mol·L-1、c(CH3OCH3)=1.2 mol·L-1,此时正、逆反应速率的大小:v(正)________v(逆)(填“>”、“<”或“=”)。
4、填空题 (9分)将4molSO2和2molO2的混合气体置于体积可变的恒压容器中,在一定条件下发生如下反应2SO2(g)+ O2(g) ?2SO3(g)? ΔH<0,该反应达平衡时,测得气体总物质的量为4.2mol,试回答:
?2SO3(g)? ΔH<0,该反应达平衡时,测得气体总物质的量为4.2mol,试回答:
(1)在该平衡时,n(SO3)=?mol ?
(2)若起始时加入1.2molSO2、0.6molO2和xmolSO3,达到平衡时各气体体积分数与上述平衡状态相同,则x的取值范围是?
(3)若反应开始时v(逆)> v(正),达到上述平衡状态时,气体的总物质的量仍为4.2mol,则起始时n(SO3)的取值范围是?
(4)若反应过程中SO2、O2、SO3物质的量变化如图所示。则反应进行至20min时,曲线发生变化的原因是______________________(用文字表达)。10 min到15 min的曲线变化的原因可能是_________(填写编号)。
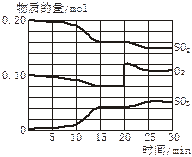
A.加了催化剂
B.缩小容器体积
C.降低温度
D.增加SO3的物质的量
5、填空题 (1)二氧化硫的催化氧化的过程如图所示,其中a、c二步的化学方程式可表示为:

SO2+V2O5 SO3+ V2O4
SO3+ V2O4
4VOSO4+O2 2V2O5+4SO3。
2V2O5+4SO3。
该反应的催化剂是?(写化学式)
(2) 550 ℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如图所示。将2.0 mol SO2和1.0 mol O2置于5 L密闭容器中,反应达平衡后,体系总压强为0.10 M Pa。试计算反应2SO3 2SO2+O2在550 ℃时的平衡常数K=?。
2SO2+O2在550 ℃时的平衡常数K=?。
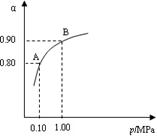
(3)550 ℃时,将2.0 mol SO2和1.0 mol O2置于5 L密闭容器中,反应 达平衡后,下列措施中能使n(SO3)/n(SO2)增大的是?
A.升高温度?
B.充入He(g),使体系总压强增大
C.再充入2 mol SO2和1 mol O2?
D.再充入1 mol SO2和1 mol O2
(4)维持温度不变条件下使之发生如下反应:2SO2+O2 2SO3,有两只密闭容器A和B。A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个容器中分别充入等物质的量的体积比为2∶1的SO2和O2的混合气体,并使A和B容积相等(如下图所示)。
2SO3,有两只密闭容器A和B。A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个容器中分别充入等物质的量的体积比为2∶1的SO2和O2的混合气体,并使A和B容积相等(如下图所示)。

试填写下列空格:
A容器达到平衡时所需的时间比B容器__________(填:“短或长”);平衡时A容器中SO2的转化率比B容器_______(填:“大或小”);达到所述平衡后,若向两容器中通入等物质的量的原反应气体,达到平衡时,A容器的混合气体中SO3的体积分数_________(填“增大”、“减小”或“不变”,下同);B容器的混合气体中SO3的体积分数_________。