|
|
|
高中化学知识点讲解《电解池原理》高频试题特训(2017年最新版)(八)
2017-11-05 23:26:18
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、填空题 (10分)如图所示装置为在直流电的作用下电解CuSO4 溶液图,其中A、B为石墨电极,
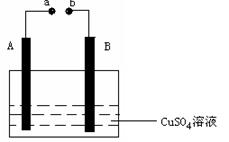
a、b为电源的两极,当接通电源后,通电一段时间后,将B电极取出洗干净并干燥后称量其质量增加了3.2g,则:
(1)a为电源的 极。b为电源的 极
(2)写出电极反应方程式:
A ,
B 。
(3)A电极析出气体体积为 L(在标准状况下)。
参考答案:20.(1)正 负 (2)4OH---4e-==O2+2H2O ; 2Cu2++4e-="=2Cu" (3)0.56
本题解析:(1)将B电极取出洗干净并干燥后称量其质量增加了3.2g,说明B电极是阴极,A电极是阳极,与阳极相连的a为电源的正极,则b为电源的负极;
(2)A极(阳极)的电极反应为4OH---4e-==O2+2H2O ,B极(阴极)的电极反应为2Cu2++4e-==2Cu;
(3)根据流经各个电极的电量相等,可知n(Cu)=3.2/64=0.05mol,得电子0.1moL,阳极失电极0.1moL,析出气体体积为(0.1/4)×22.4=0.56L。
考点:考查电解池。
本题难度:一般
2、填空题 二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
(1)工业上制备ClO2的反应原理常采用:2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl。
①浓盐酸在反应中显示出来的性质是_______(填序号)。
A.只有还原性
B.还原性和酸性
C.只有氧化性
D.氧化性和酸性
| ②若上述反应中产生0.1 mol ClO2,则转移电子的物质的量为_______mol。
(2)目前已开发出用电解法制取ClO2的新工艺。
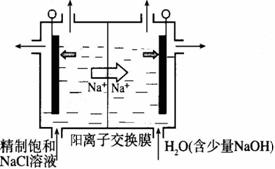
①上图示意用石墨做电极,在一定条件下电解饱和食盐水制取ClO2。写出阳极产生ClO2的电极反应式: 。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为_________mol;用平衡移动原理解释阴极区pH增大的原因 。
(3)ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果。某工厂污水中含
CN- a mg/L,现用ClO2将CN-氧化,只生成两种气体,其离子反应方程式为 。
参考答案:(1)①B (1分) ② 0.1 (1分)
(2)①Cl- - 5e- + 2H2O = ClO2↑+ 4H+ (2分)
②0.01 (2分) 在阴极发生2H+ + 2e- =H2↑,H+浓度减小,使得H2O OH- +H+的平衡向右移动,OH-浓度增大,pH增大 (2分) OH- +H+的平衡向右移动,OH-浓度增大,pH增大 (2分)
(3)2ClO2+2CN- = N2↑+ 2CO2↑+2Cl-(2分)
本题解析:(1)①4HCl中2HCl转化为Cl2,表现还原性,2HCl转化为NaCl,表现酸性,故B项正确。
②NaClO3中Cl元素为+5价,ClO2中Cl元素为+4价,所以产生0.1 mol ClO2,转移电子的物质的量为0.1mol。
(2)①惰性电极电解饱和食盐水,阳极Cl?失电子生成ClO2,Cl元素由-1价升高至+4价,配平可得电极方程式:Cl- - 5e- + 2H2O = ClO2↑+ 4H+
②阴极产生的气体体积为112 mL(标准状况),则生成H2:0.112L÷22.4L/mol=0.005mol,通过阳离子交换膜的阳离子为Na+,物质的量为0.01mol;阴极上H2O电离出的H+放电:2H+ + 2e- =H2↑,H+浓度减小,使得H2O OH- +H+的平衡向右移动,OH-浓度增大,pH增大 。 OH- +H+的平衡向右移动,OH-浓度增大,pH增大 。
(3)CN-被氧化转化为CO2和N2,所以离子方程式为:2ClO2+2CN- = N2↑+ 2CO2↑+2Cl-
考点:本题考查氧化还原反应的分析、电解原理及计算、电极方程式和离子方程式的书写。
本题难度:困难
3、选择题 正确掌握化学用语是学好化学的基础,下列有关化学用语正确的是
A.HCO3-的水解方程式:HCO3-+H2O?H3O++CO32-
B.乙烯的燃烧热是bkJ/mol ,表示燃烧热的热化学方程式为C2H4(g)+3O2(g)=2CO2(g)+2H2O(g)△H=-bkJ/mol
C.以铜为电极电解氯化铜溶液::Cu2++2Cl-== Cu +Cl2↑。
D.在酸性碘化亚铁溶液中通入少量氧气:4I-+ O2 + 4H+ = 2I2 + 2H2O
|
参考答案:D
本题解析:A、碳酸氢根离子水解生成碳酸和氢氧根离子,错误;B、乙烯燃烧热是指1mol的乙烯完全燃烧生成二氧化碳和液态水时放出的热量,不是水蒸气,错误;C、铜作电极时,电解池的阳极则是Cu失去电子,不是氯离子,所以不会产生氯气,错误;D、氧气与酸性的KI发生氧化还原反应生成碘单质和水,符合离子方程式的书写,正确,答案选D。
考点:考查离子方程式书写正误的判断
本题难度:一般
4、选择题 以惰性电极电解一定浓度的CuSO4溶液,一段时间后取出电极,加入9.8 g Cu(OH)2后溶液与电解前相同,则电解时电路中流过的电子为
A.0.1mol
B.0.2mol
C.0.3mol
D.0.4mol
参考答案:D
本题解析:加入9.8 g Cu(OH)2后溶液与电解前相同,这说明电解的后阶段是电解水,生成氧气和氢气。氢氧化铜的物质的量是0.1mol,则反应中生成的氧气就是0.1mol,所以转移的电子的物质的量是0.1mol×4=0.4mol,答案选D。
点评:电解的有关计算关键是准确判断出阴阳极的放电离子和产物,然后依据电子的得失守恒计算即可。
本题难度:一般
5、选择题 某小组设计电解饱和食盐水的装置如图,通电后两极均有气泡产生,下列叙述正确的是
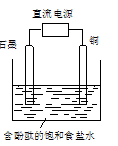
A.铜电极附近观察到黄绿色气体
B.石墨电极附近溶液呈红色
C.溶液中的Na+向石墨电极移动
D.铜电极上发生还原反应
参考答案:D
本题解析:依题知,“两极均有气泡”,则说明铜做阴极,石墨做阳极,电解饱和食盐水。根据放电顺序,Cl-石墨电极上放电氧化反应,产生氯气;H+铜极上放电发生还原反应,产生氢气。答案选D。
本题难度:一般

