1、选择题 关于反应X2+2Y2=2XY2(在XY2中X为阳离子)的叙述中,正确的是( )
A.X2被氧化,Y2显氧化性
B.Y2被氧化,X2显氧化性
C.X2是还原剂,Y2被氧化
D.Y2被氧化,X2+是氧化产物
参考答案:A
本题解析:
本题难度:一般
2、选择题 对反应CaH2+2H2O=Ca(OH)2+2H2↑,(CaH2中H显-1价)下列判断正确的是( )
A.H2只是氧化产物
B.得电子原子和失电子原子的个数比为2:1
C.CaH2得电子
D.H2O是氧化剂
参考答案:D
本题解析:解析:A.由反应可知,氧化产物与还原反应均为氢气,故A错误;
B.得电子和失电子的原子都是H原子,且得电子和失电子的H原子个数相等,为1:1,故B错误;
C.CaH2中H元素为-1价,在反应中失电子,故C错误;
D.H2O中H元素为+1价,在反应中得电子化合价降低,所以水是氧化剂,故D正确;
所以答案选D
本题难度:简单
3、选择题 Na2FeO4是一种高效多功能水处理剂,应用前景十分看好.一种制备Na2FeO4的方法可用化学方程式表示如下:
2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,对此反应下列说法中正确的是( )
A.Na2O2只作氧化剂
B.Na2FeO4既是氧化产物又是还原产物
C.O2是还原产物
D.2molFeSO4发生反应时,反应中共有8mol电子转移
参考答案:A、过氧化钠中氧元素的化合价有的升高到0价有的降低到-2价,所以Na2O2即是氧化剂,又是还原剂,故A错误;
B、反应中,Na2FeO4中的铁元素化合价为+6价,是从硫酸亚铁中+2价的铁元素升来的,所以硫酸亚铁是还原剂,被氧化得到氧化产物Na2FeO4,同时过氧化钠中的-1价的氧元素化合价降低,Na2FeO4中的-2价氧元素就来自过氧化钠,所以Na2FeO4又是还原产物,故B正确;
C、氧气中0价的氧元素是过氧化钠中-1价的氧元素升高来的,所以氧气是氧化产物,故C错误;
D、反应中元素化合价升高的数目为:2×(6-2)+2×(1-0)=10,所以2molFeSO4发生反应时,反应中转移电子的数目为10mol,故D错误.
故选B.
本题解析:
本题难度:一般
4、选择题 下列反应不属于氧化还原反应的是( )
A.Zn+2HCl=ZnCl2+H2↑
B.Ca(ClO)2+2HCl=CaCl2+2HClO
C.Pb3O4+8HCl(浓)=3PbCl2+Cl2↑+4H2O
D.3Cl2+6KOH(浓)
5KCl+KClO3+3H2O
参考答案:A.Zn+2HCl=ZnCl2+H2↑中Zn元素的化合价升高,H元素的化合价降低,则属于氧化还原反应,故A不选;
B.Ca(ClO)2+2HCl=CaCl2+2HClO中没有元素的化合价变化,则不属于氧化还原反应,故B选;
C.Pb3O4+8HCl(浓)=3PbCl2+Cl2↑+4H2O中Pb元素的化合价降低,Cl元素的化合价升高,则属于氧化还原反应,故C不选;
D.3Cl2+6KOH(浓)?△?.?5KCl+KClO3+3H2O中Cl元素的化合价既升高又降低,则属于氧化还原反应,故D不选;
故选B.
本题解析:
本题难度:一般
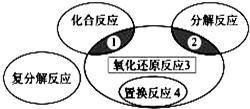
5、选择题 氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于区域3的是( )
A.2H2+O2?
2H2O
B.CuO+CO??Cu+CO2
C.2NaHCO3??Na2CO3+H2O+CO2↑
D.Zn+H2SO4=ZnSO4+H2↑