1、填空题 (1)写出Fe2(SO4)3在水溶液中的电离方程式:______
(2)写出下列离子方程式对应的一个化学方程式:2H++CO32-=H2O+CO2↑______
(3)用“双线桥法”标明电子转移的方向和数目.
MnO2+4HCl
MnCl2+Cl2↑+2H2O
该反应中氧化剂与还原剂物质的量之比为______
该反应的离子方程式为______
(4)根据下列四个反应:
①Cl2+2KI=2KCl+I2?②2FeCl2+Cl2=2FeCl3
③2FeCl3+2HI=2FeCl2+2HCl+I2?④H2S+I2=S+2HI
可以判断FeCl3、Cl2、I2、S四种物质的氧化性由强到弱的正确顺序是______.
参考答案:(1)Fe2(SO4)3在水溶液中的电离方程式为:Fe2(SO4)3=2Fe2++3SO42-,故答案为:Fe2(SO4)3=2Fe2++3SO42-;
(2)2H++CO32-=H2O+CO2↑对应的化学反应为酸与碳酸氢盐的反应,化学方程式可写为HCl+NaHCO3-=H2O+NaCl+CO2↑,故答案为:HCl+NaHCO3-=H2O+NaCl+CO2↑;
(3)MnO2+4HCl?△?.?MnCl2+Cl2↑+2H2O,反应中Mn:+4降为+2,得到2mol电子,MnO2是氧化剂,还原产物是Mn2+
Cl:-1升为0,失去1 mol电子,由于有2mol Cl化合价改变,所以共失去2mol电子,HCl是还原剂,氧化产物是Cl2,氧化剂和还原剂的物质的量之比为1:2,反应的离子方程式为MnO2+4H++2Cl-?△?.?Mn2++Cl2↑+2H2O,
电子转移的方向和数目
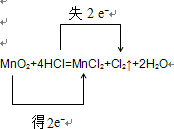
故答案为:

;1:2;MnO2+4H++2Cl-?△?.?Mn2++Cl2↑+2H2O;
(4)①反应中Cl2>I2;
②反应中Cl2>FeCl3;
③反应中FeCl3>I2;
④反应中I2>S,所以氧化性顺序为Cl2>FeCl3>I2>S,故答案为:Cl2>FeCl3>I2>S.
本题解析:
本题难度:一般
2、简答题 已知A为常见的金属单质,根据图示的关系,回答下列问题.
(1)确定A、B、C、D的化学式,A为______,B为______,C为______,D为______,
(2)在上述①~⑧的反应中属于非氧化还原反应的有______.
(3)写出下列反应的化学(或离子)方程式:
D→C(写离子方程式)______;
E→F(写化学方程式)______.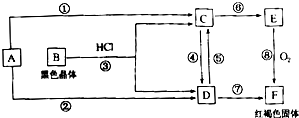
参考答案:B是黑色晶体,应为Fe3O4,它与HCl反应生成FeCl2和FeCl3,红褐色固体F为Fe(OH)3,则E为Fe(OH)2,C为FeCl2,D为FeCl3,所以A为Fe,
(1)由以上分析可知A为Fe,B为Fe3O4,C为FeCl2,D为FeCl3,故答案为:Fe;Fe3O4;FeCl2;FeCl3;
(2)在上述①~⑧的反应中①、②、⑧有单质参加反应,肯定为氧化还原反应,④、⑤为FeCl2和FeCl3之间的转化,化合价发生变化,为氧化还原反应,③、⑥、⑦没有化合价发生变化,不是氧化还原反应,
故答案为:③、⑥、⑦;
(3)D→C转化可由FeCl3与Fe反应生成FeCl2,反应的离子方程式为2Fe3++Fe═3Fe2+,
E→F为Fe(OH)2与氧气反应生成,反应的化学方程式为4Fe(OH)2+O2+2H2O═4Fe(OH)3,
故答案为:2Fe3++Fe═3Fe2+;4Fe(OH)2+O2+2H2O═4Fe(OH)3.
本题解析:
本题难度:一般
3、简答题 现有中学化学中常见的几种物质:①O2、②Mg、③CO、④WO3、⑤W、⑥CO2.
请回答下列问题:
(1)①、②、③、④四种物质中常用作还原剂的有______(填序号).
(2)请将③、④、⑤、⑥对应物质填入下列横线上,以组成一个氧化还原反应方程式:______+______
______+______
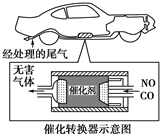
(3)随着人们环保意识的增强,许多汽车都已经装上了如图所示的尾气处理装置.在催化剂的作用下,尾气中两种主要的有毒气体反应生成两种无害气体,两种无害气体均为空气中的成分,写出该反应的化学方程式:______.该反应中______是氧化剂.
参考答案:(1)①、②、③、④四种物质中处于较低价态或最低价态的物质常具有还原性,Mg是活泼金属,CO为低价态化合物,常用作还原剂,故答案为:②③;
(2)由元素化合价可知③、④、⑤、⑥组成一个氧化还原反应,应为WO3和CO的反应,反应的方程式为3CO+WO3△.W+3CO2,故答案为:3CO;WO3;W;3CO2;
(3)NO和CO在催化条件下生成两种无害气体均为空气中的成分,应为二氧化碳和氮气,反应的方程式为2CO+2NO催化剂.N2+2CO2,反应中N元素化合价降低,NO为氧化剂,
故答案为:2CO+2NO催化剂.N2+2CO2;NO.
本题解析:
本题难度:一般
4、简答题 一个完整的氧化还原反应方程式可以拆开,写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”.如2Fe3++Cu=2Fe2++Cu2+,可拆写为氧化反应式:Cu-2e-=Cu2+,还原反应式:2Fe3++2e-=2Fe2+.据此,回答下列问题:
(1)将反应?2Al+2OH-+2H2O=2AlO2-+3H2↑拆写为两个“半反应式”:
氧化反应式:______,还原反应式:______.
(2)已知某反应的两个“半反应式”为:CH4+10OH--8e-=CO32-+7H2O,O2+2H2O+4e-=4OH-,则氧化还原反应离子方程式为______.
参考答案:(1)在2Al+2OH-+2H2O=2AlO2-+3H2↑反应中,Al元素化合价升高,被氧化生成AlO2-,
反应式为2Al+8OH--6e-=2AlO2-+4H2O,反应H元素化合价降低,H2O为氧化剂得电子被还原,反应式为6H2O+6e-=6OH-+3H2↑,
故答案为:2Al+8OH--6e-=2AlO2-+4H2O;6H2O+6e-=6OH-+3H2↑;
(2)已知某反应的两个“半反应式”为:CH4+10OH--8e-=CO32-+7H2O,O2+2H2O+4e-=4OH-,则两个半反应相加得总反应,为CH4+2O2+2OH-=CO32-+3H2O,
故答案为:CH4+2O2+2OH-=CO32-+3H2O.
本题解析:
本题难度:一般
5、简答题 已知盐酸参加的下列三个反应:
①CaCO3+2HCl═CaCl2+CO2↑+H2O?②Fe+2HCl═FeCl2+H2↑? ③MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
(1)判断上述三个反应中属于氧化还原反应的是______,其中盐酸作还原剂的是______.
(2)上述反应说明盐酸具有______性,______性,______性.
参考答案:(1)①CaCO3+2HCl═CaCl2+CO2↑+H2O中,各元素化合价都不变,所以不是氧化还原反应,为复分解反应,
②Fe+2HCl═FeCl2+H2↑中,铁失电子化合价升高,盐酸中氢元素得电子化合价降低,所以该反应是氧化还原反应,盐酸作氧化剂,
③MnO2+4HCl(浓)?△?.?MnCl2+Cl2↑+2H2O中锰元素得电子化合价降低,氯元素失电子化合价升高,所以该反应是氧化还原反应,且盐酸是还原剂,故答案为:②③;③;
(2)通过(1)知,①中盐酸起酸作用,②中盐酸作氧化剂,③中盐酸作还原剂,故答案为:酸;氧化;还原.
本题解析:
本题难度:一般