1、实验题 硫酸钠-过氧化氢-氯化钠加合物(xNaSO4·yH2O2·zNaCl)又称固体双氧水,是一种新型精细化工产品,具有漂白、杀菌、消毒等作用。为探究该加合物的组成,某化学兴趣小组设计并进行了如下实验:
第一步:准确称取6.945g样品,配制成250.00ml无色溶液A
第二步:准确量取25.00ml溶液A于锥形瓶中,加适量稀硫酸酸化后,用0.0400mol/LKMnO4标准溶液滴定至终点,消耗溶液KMnO420.00ml
第三步:另取25.00ml溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.932g.
请回答下列问题:
(1)欲配制无色溶液A,所需要的仪器除药匙、分析天平、玻璃棒、胶头滴管外,还应有 。
(2)配平下列离子方程式______MnO4-+_____H2O2+_________=______Mn2++_____O2↑+______。
(3)滴定前,KMnO4标准溶液应盛装于中 (填仪器名称),滴定终点现象为 。
(4)第三步能否通过加入AgNO3溶液的方法来测定?为什么
(5)滴定前,滴定管用蒸馏水洗净后,未用KMnO4标准溶液润洗,则Y值______________(填“偏
高 偏低 无影响”)
(6)通过计算确定样品的组成为 。
参考答案:(1)烧杯、250 mL容量瓶(2分) (2)2,5,6H+,2,5,8H2O(2分)
(3)酸式滴定管(1分)
当滴入最后一滴KMnO4溶液时,待测液颜色由无色变为浅紫色,且半分钟不褪色(2分)
(4)不能(1分) 加入AgNO3溶液使Cl-完全沉淀的同时,要生成Ag2SO4微溶物,会使最终测定结果中z值偏高(2分) (5)偏高(2分) (6)4Na2SO4?2H2O2?NaCl(4分)
本题解析:(1)欲配制250.00ml无色溶液A,所需要的仪器除药匙、分析天平、玻璃棒、胶头滴管外,还应有溶解时需要的烧杯以及250ml容量瓶。
(2)高锰酸钾加压强氧化性,在反应中Mn元素的化合价从+7价降低到+2价,得到5个电子。双氧水中氧元素的化合价从-1价升高到0价,失去1个电子。根据电子的得失守恒可知氧化剂高锰酸钾与还原剂双氧水的物质的量之比是2:5。反应在酸性条件下进行,因此反应物还有氢离子参加。又因为原子是守恒的,所以还应该有水生成,因此配平后的离子方程式为2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O.。
(3)酸性高锰酸钾溶液具有强氧化性和酸性,因此滴定前,KMnO4标准溶液应盛装于中酸式滴定管中。由于酸性高锰酸钾溶液显紫红色,所以滴定终点现象为当滴入最后一滴KMnO4溶液时,待测液颜色由无色变为浅紫色,且半分钟不褪色。
(4)根据物质的组成可知,加入AgNO3溶液使Cl-完全沉淀的同时,会生成Ag2SO4微溶物,从而使最终测定结果中z值偏高,所以不能用硝酸银溶液代替。
(5)滴定前,滴定管用蒸馏水洗净后,未用KMnO4标准溶液润洗,则导致酸性高锰酸钾溶液的浓度减小,因此再滴定双氧水时,消耗高锰酸钾溶液的体积增加,从而导致Y值偏高。
(6)25.00ml溶液A消耗高锰酸钾溶液的体积是20.00ml,则250ml溶液A消耗高锰酸钾溶液的体积是200.00ml,则高锰酸钾的物质的量=0.2L×0.0400mol/L=0.00800ml。所以根据反应的方程式可知,消耗双氧水的物质的量=(0.00800mol÷2)×5=0.0200mol。25.00ml溶液A得到白色沉淀0.932g,该固体是硫酸钡,物质的量=0.932g÷233g/mol=0.004mol。所以250.00ml溶液A生成白色沉淀的物质的量是0.04mol,即硫酸钠的物质的量是0.04mol。因此6.945g样品中氯化钠的物质的量=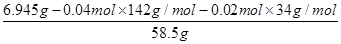 =0.01mol,则x:y:z=0.04:0.02:0.01=4:2:1,因此化学式为4Na2SO4?2H2O2?NaCl。
=0.01mol,则x:y:z=0.04:0.02:0.01=4:2:1,因此化学式为4Na2SO4?2H2O2?NaCl。
考点:考查一定物质的量浓度的配制;氧化还原反应的配平和有关计算;氧化还原滴定仪器选择、误差分析以及物质组成的有关计算
本题难度:一般
2、选择题 制备Fe3O4纳米颗粒的总反应如下:3Fe2++ 2S2O32-+O2+4OH-= Fe3O4 + S4O62-+2H2O。下列说法正确的是 ?
A.当转移1mol电子时,消耗56g S2O32-
B.在反应中硫元素被氧化,铁元素被还原
C.还原剂是Fe2+,氧化剂是S2O32-和O2
D.每生成1mol Fe3O4,转移3mol电子
参考答案:A
本题解析:反应中两个亚铁离子的化合价由+2价升至+3价(Fe3O4中有两个+3价铁), S2O32-中的四个硫全部转变为S4O62-,总体化合价由+8价升至+10价,升高2价,共升高四价;而氧气中氧元素由0价降至—2价,降低四价,反应中有四个电子的转移,所以还原剂为Fe2+、2S2O32-,氧化剂为O2。A.当转移1mol电子时,消耗0.5molS2O32-?即56g。B.在反应中硫、铁元素都被氧化。C.还原剂是Fe2+和S2O32-,氧化剂是和O2?。D.每生成1mol Fe3O4,转移4mol电子,错误。
本题难度:一般
3、简答题 现有短周期元素组成的A、B、C、D、E五种物质,存在如下转化关系(部分产物已略去),其中E为黑色粉末,D为无色气体.
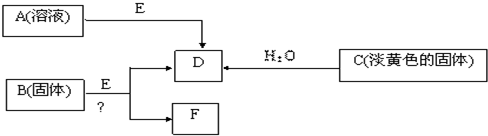
(1)若B为含氯元素的钾盐,与浓盐酸反应可以生成黄绿色气体,且1mol?B转移5mol?电子,则B与浓盐酸反应的化学方程式为______.?生成的氧化产物与还原产物的物质的量之比为______;
(2)将F从混合物中分离出来的实验操作步骤为______、______、______.由A制得2mol?D时,转移电子数为______?mol
(3)电解F的饱和水溶液得到碱溶液M,写出该反应的离子方程式;______,若将浓度为?c?mol?L-1?的M溶液与0.2mol?L-1?的一元酸HA等体积混合,所得溶液pH=7.溶液中离子浓度的大小关系为______?(浓度用C表示).
(4)固体C与FeCl3溶液按物质的量为2:1反应的离子方程式______;
将Fe(OH)3和NaOH与NaClO混合作用后,是制得緑色水处理剂(Na2FeO4)的一种方法,请完成下列方程式:
______Fe(OH)3+______NaOH+______NaClO=______Na2FeO4+______NaCl+______H2O.
参考答案:短周期元素组成的A、B、C、D、E五种物质,C是淡黄色固体,与水反应生成无色气体D,故C为Na2O2,D为O2,E为黑色粉末,由A溶液E
本题解析:
本题难度:一般
4、填空题 过氧化钙晶体[CaO2·8H2O]较稳定,呈白色,微溶于水,能溶于酸性溶液。广泛应用于环境杀菌、消毒等领域。
★过氧化钙晶体的制备
工业上生产CaO2·8H2O的主要流程如下:
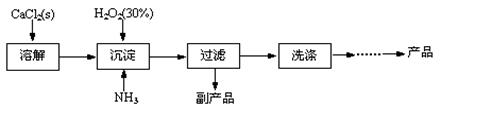
(1)用上述方法制取CaO2·8H2O的化学方程式是?。
(2)沉淀时常用冰水控制温度在10℃以下和通入过量的NH3,其可能原因分别是
①?;②?。
★过氧化钙晶体含量的测定
准确称取0.3000g产品于锥形瓶中,加入30 mL蒸馏水和10 mL 2.000 mol·L-1 H2SO4,用0.0200mol·L—1 KMnO4标准溶液滴定至终点。重复上述操作两次。H2O2和KMnO4反应的离子方程式为2MnO4-+5 H2O2+6H+=2Mn2++5O2↑+8H2O
(3)滴定终点观察到的现象为?。
(4)根据表1数据计算产品中CaO2·8H2O的质量分数(写出计算过程):
滴定次数
| 样品的质量/g
| KMnO4溶液的体积/mL
|
滴定前刻度/mL
| 滴定后刻度/mL
|
1
| 0.3000
| 1.02
| 24.04
|
2
| 0.3000
| 2.00
| 25.03
|
3
| 0.3000
| 0.20
| 23.24
|
?
表1. KMnO4标准溶液滴定数据
参考答案:(1)CaCl2+H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH4Cl;(2)①温度低可减少过氧化氢的分解,提高过氧化氢的利用率(或防止过氧化氢的分解);②通入过量的NH3使溶液呈碱性,抑制CaO2·8H2O的溶解(或提高产品的产率);(3)当滴入最后一滴KMnO4标准溶液后由无色变浅红色,且半分钟内不褪色。(4)82.91%? 5 CaO2·8H2O?~?5 H2O?~? 2 KMnO4
n(CaO2·8H2O)=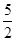 n(KMnO4)=
n(KMnO4)= 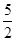 ×0.0200mol/L×23.03mL×10-3L/mL=1.1151×10-3mol,所以CaO2·8H2O的质量分数为:
×0.0200mol/L×23.03mL×10-3L/mL=1.1151×10-3mol,所以CaO2·8H2O的质量分数为: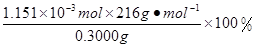 =82.91%
=82.91%
本题解析:(1)根据题意可知:用上述方法制取CaO2·8H2O的化学方程式是CaCl2+H2O2+2NH3+ 8H2O= CaO2·8H2O↓+2NH4Cl。(2)沉淀时常用冰水控制温度在10℃以下和通入过量的NH3是因为①温度低可减少过氧化氢的分解,提高过氧化氢的利用率;②通入过量的NH3使溶液呈碱性,抑制CaO2·8H2O的溶解(或提高产品的产率)。(3)CaO2+2H2O=Ca(OH)2+H2O2; 2MnO4-+5 H2O2+6H+=2Mn2++5O2↑+8H2O.当达到滴定终点时会观察到溶液由无色变为浅红色,半分钟内不褪色。(4)由方程式得关系式为:5CaO2·8H2O ~2KMnO4。消耗的KMnO4溶液的体积为{(24.04-1.02)+( 25.03-2.00)+( 23.24-0.20)}ml÷3=23.03ml.n(CaO2·8H2O)=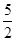 n(KMnO4)=
n(KMnO4)= 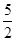 ×0.0200mol/L×23.03mL ×10-3L/mL ="1.1151" ×10-3mol 。所以CaO2·8H2O的质量分数为:
×0.0200mol/L×23.03mL ×10-3L/mL ="1.1151" ×10-3mol 。所以CaO2·8H2O的质量分数为: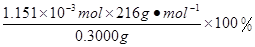 =82.91%。2·8H2O的制备原理及操作注意问题、滴定终点的判断、物质含量的测定的知识。
=82.91%。2·8H2O的制备原理及操作注意问题、滴定终点的判断、物质含量的测定的知识。
本题难度:一般
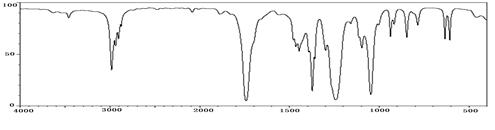
5、实验题 (10分)已知某种有机物A的质谱图和红外光谱图如下:
 ?
?
图2:红外光谱图
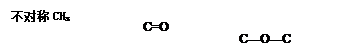
回答下列问题:
⑴结合以上谱图推断:有机物A的相对分子质量为?,分子式为?,
有机物A的核磁共振氢谱图中有?种吸收峰,峰面积之比为?;该有机
物与氢氧化钠溶液在加热条件下反应的化学方程式为:?。
⑵直链烃B的相对分子质量比A小4,含2个甲基,并能使溴的四氯化碳溶液褪色,
写出B所有可能的结构简式:
?、?。?
⑶链烃C是B的同系物,且其对乙烯的相对密度为3,C的核磁共振氢谱显示:C中
只含有一种氢原子。则C在一定条件下发生聚合反应的方程式为:
?。
参考答案:(1)74 ;? C3H6O2;? 2 ;? 1:1 ;
CH3COOCH3 +NaOH CH3COONa + CH3OH
CH3COONa + CH3OH
(2)
本题解析:根据质谱图可知,该有机物的相对分子质量为74;由红外光谱图可看出该分子
中有不对称CH3,因此该分子中有2个CH3,由图也可以看出含有碳氧双键,碳氧单
键。因此A的结构简式为:CH3COOCH3。
本题难度:简单