1、填空题 氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40~50 ℃时反应可生成它。CuH不稳定,易分解;在氯气中能燃烧;与稀盐酸反应能生成气体;Cu+在酸性条件下发生的反应是2Cu+ Cu2++Cu。根据以上信息,结合自己所掌握的化学知识,回答:
Cu2++Cu。根据以上信息,结合自己所掌握的化学知识,回答:
(1)用CuSO4溶液和“另一物质”制CuH的反应中,用氧化还原观点分析,这“另一物质”在反应中所起的作用是 。?
(2)写出CuH在氯气中燃烧的化学反应方程式?
(3)CuH溶解在稀盐酸中生成的气体是 ,如果反应中生成了标准状况下22.4 L的气体,被还原的离子得电子的物质的量是 。?
参考答案:(1)还原剂
(2)2CuH+3Cl2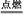 2CuCl2+2HCl
2CuCl2+2HCl
(3)H2 1.5 mol
本题解析:(1)Cu2+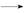 Cu+,铜元素化合价降低,被还原,所以加入的应该是还原剂。
Cu+,铜元素化合价降低,被还原,所以加入的应该是还原剂。
(2)CuH在氯气中能燃烧,铜元素和氢元素都被氯气氧化,故可推知产物为氯化铜和氯化氢,根据得失电子守恒和原子守恒就可以配平反应方程式。
(3)CuH溶解在稀盐酸中,氢元素发生归中反应,生成的气体为氢气,同时根据信息Cu+在酸性条件下发生的反应是2Cu+ Cu2++Cu,综上所述总化学方程式是:2CuH+2HCl
Cu2++Cu,综上所述总化学方程式是:2CuH+2HCl CuCl2+Cu+2H2↑,
CuCl2+Cu+2H2↑,
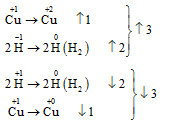
则生成2 mol H2时,转移电子3 mol,生成1 mol H2时,转移电子为1.5 mol。
本题难度:一般
2、填空题 铁能在稀硝酸中溶解:
 →Fe(NO3)3+NO↑+2H2O
→Fe(NO3)3+NO↑+2H2O
24.在上述方程式上标出电子转移的方向和数目。
25.该反应中被还原的元素是 ,还原剂是 。
26.若有0.1 mol铁参加反应,被还原的HNO3为 mol。
参考答案:24.略,(2分,方向和数目各1分)。
25.+5价的N(1分),铁(1分)。
26.0.1(2分)
本题解析:24.在方程式中Fe→Fe3+,失去3e-,故 。
。
25.反应中化合价降低的元素是被还原,为+5价N,失去电子的物质是还原剂,是Fe。
26.反应中被还原的HNO3生成NO,故有0.1 mol铁参加反应,被还原的HNO3为0.1mol。
考点:氧化还原反应的概念及相关计算。
本题难度:一般
3、计算题 (10分)
用KMnO4氧化密度为1.19g/cm3,溶质的质量分数为36.5%的盐酸。反应方程式如下:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
(1)用双线桥法标出上述反应中电子得失数目、化合价变化,并指出氧化剂和还原剂。
(2)求所用盐酸的物质的量浓度。
(3)15.8gKMnO4能使多少克HCl发生上述反应?产生的Cl2在标准状况下的体积为多少?
参考答案:(共10分)
(1)

氧化剂:KMnO4?还原剂:HCl?
(2)解:
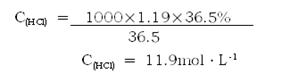
(3)设15.8gKMnO4能同xgHCl发生反应,生成标准状况下yLCl2。
2KMnO4?+ 16HCl =" 2KCl" + 2MnCl2 + 5Cl2↑ + 8H2O
2×158 g? 16×36.5 g?5×22.4 L
15.8 g? x g?y L ?

本题解析:
试题分析 :

氧化剂:KMnO4?(化合价降低 )?还原剂:HCl (化合价升高)
由c=1000ρw/M得:

设15.8gKMnO4能同xgHCl发生反应,生成标准状况下yLCl2。
2KMnO4?+ 16HCl =" 2KCl" + 2MnCl2 + 5Cl2↑ + 8H2O
2×158 g? 16×36.5 g?5×22.4 L
15.8 g? x g?y L ?

点评: 一、氧化还原反应的特点:氧化剂得电子,化合价降低,具有较强氧化性;还原剂失电子,化合价升高,具有较强还原性;
二、双线桥的表示基本步骤:
1.标变价
明确标出所有发生氧化还原反应的元素的化合价,不变价的元素不标化合价。
2.连双线
将标化合价的同一元素用直线加箭头从反应物指向生成物(注意:箭头的起止一律对准各元素)
3.标得失
①标电子转移或偏离数
明确标出得失电子数,格式为“得/失 发生氧化还原反应原子个数×单位原子得失电子数”
②标化合价变化
一律标出化合价的变化,只有“化合价升高”“化合价降低”这两种写法,不可写为“升价”“降价”等
③标出元素反应类型
一律标出元素所发生的反应,“被氧化”或“被还原”,其余写法均不正确
4.检查得失电子守恒
检查得失电子数是否相等,如不相等则重新分析。
本题难度:一般
4、选择题 某反应的反应物与生成物有:K2Cr2O7、KCl、CrCl3、Cl2、HCl、H2O,已知反应过程中发生如下变化:K2Cr2O7→CrCl3,则下列说法不正确的是?
A.由此反应可知氧化性K2Cr2O7>Cl2
B.氧化剂和还原剂的物质的量之比为1:6
C.当转移0.2mol电子时,生成的还原产物的物质的量为0.1mol
D.发生氧化还原反应的氯元素与参加反应的氯元素的比为3:7
参考答案:C
本题解析:根据物质的氧化性、还原性的强弱规律可知反应为:K2Cr2O7+14HCl= 2KCl+2CrCl3+3Cl2+7H2O. A.由此反应可知氧化性K2Cr2O7>Cl2,正确;B.氧化剂和还原剂的物质的量之比为1:6,正确;C.由方程式可知:每转移6mol的电子,生成氧化产物3mol。当转移0.2mol电子时,生成的氧化产物的物质的量为0.1mol,错误;D.发生氧化还原反应的氯元素与参加反应的氯元素的比为6:14=3:7,错误。
本题难度:一般
5、选择题 实验室制Cl2的原理:MnO2+4HCl(浓)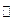 MnCl2+Cl2↑+2H2O,当制取1mol Cl2时,所需氧化剂与还原剂的物质的量之比为(?)
MnCl2+Cl2↑+2H2O,当制取1mol Cl2时,所需氧化剂与还原剂的物质的量之比为(?)
A.4:1
B.1:4
C.1:2
D.2:1
参考答案:C
本题解析:略
本题难度:简单