1、推断题 X、Y、Z均为短周期元素,X元素的气态氢化物的水溶液滴入无色酚酞变红,Y元素的最外层电子数是次外层电子数的2倍,Z元素是短周期元素中原子半径最大的元素(He、Ne、Ar除外)。
(1)写出X的元素符号?,其原子结构示意图为?。
(2)元素Y的最简单氢化物的化学式?。
(3)Z元素原子的质子数为?,Z元素的最高价氧化物对应的水化物的电子
式为?。
(4)X元素最高价氧化物对应的水化物与氧化铝反应的离子方程式为?。
(5)Y元素的最高价氧化物和Z元素的过氧化物发生氧化还原反应的化学方程式为?。
参考答案:(1)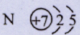 (2)
(2) (3)11?
(3)11?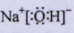
(4)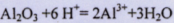 (5)
(5)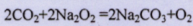
本题解析:X、Y、Z均为短周期元素,X元素的气态氢化物的水溶液滴入无色酚酞变红,该气态氢化物为氨气,所以X为N,Y元素的最外层电子数是次外层电子数的2倍,所以Y为C,Z元素是短周期元素中原子半径最大的元素(He、Ne、Ar除外),所以Z为Na;故(1)X的元素符号和原子结构示意图分别为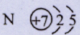 ;(2)元素Y的最简单氢化物的化学式为
;(2)元素Y的最简单氢化物的化学式为 ;(3)Z元素原子的质子数为11,Z元素的最高价氧化物对应的水化物为NaOH,其电子式为
;(3)Z元素原子的质子数为11,Z元素的最高价氧化物对应的水化物为NaOH,其电子式为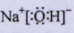 ;(4)X元素最高价氧化物对应的水化物与氧化铝反应的离子方程式为:
;(4)X元素最高价氧化物对应的水化物与氧化铝反应的离子方程式为: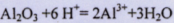 ;(5)Y元素的最高价氧化物为二氧化碳,而Z元素的过氧化物为过氧化钠,所以两者发生氧化还原反应的化学方程式为
;(5)Y元素的最高价氧化物为二氧化碳,而Z元素的过氧化物为过氧化钠,所以两者发生氧化还原反应的化学方程式为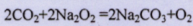 。
。
点评:本题综合考查了元素周期表,元素及其化合物,涉及考查了电子式、离子方程式的书写等等,该题有一定的综合性,难度中等。
本题难度:一般
2、选择题 四种主族元素的离子aXm+、bYn+、cZn-和dRm-(a、b、c、d为元素的原子序数),它们具有相同的电子层结构,若m>n,则下列叙述正确的是( )。
①a-b=n-m ②元素的原子序数:a>b>c>d ③元素非金属性:Z>R ④最高价氧化物对应的水化物的碱性:X>Y
A.只有③
B.①②③④
C.①②③
D.②③
参考答案:D
本题解析:由题意知,a-m=b-n=c+n=d+m,又m >n,则①错误,②正确。主族元素简单阳离子所带的正电荷数为其族序数,阴离子所带的负电荷数为8-族序数,故Z、R位于X、Y的上一周期,且Z在R后,X在Y后,故③正确,④错误。综上所述,D正确。
本题难度:一般
3、选择题 已知A的原子序数是a,B2-与A3+具有相同的电子层结构,则B元素的原子序数为
A.a+5
B.a-5
C.a+1
D.a -1
参考答案:B
本题解析:B2-与A3+具有相同的电子层结构,则B元素的原子序数为a-3-2=a-5,答案选B。
点评:该题是高考中的常见题型,属于基础性试题的考查,难度不大。该题侧重对基础性知识的巩固与检验,有利于调动学生的学习兴趣,培养学生的学习积极性。该题的关键是记住组成原子的几种微粒之间的关系,然后灵活运用即可。
本题难度:简单
4、填空题 (8分)阅读下表中部分短周期主族元素的相关信息:
元素代号
| 相关信息
|
T
| T的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子
|
X
| X的原子最外层电子数是其内层电子数的三倍
|
Y
| 在第三周期元素中,Y的简单离子半径最小
|
Z
| T、X、Z组成的36电子的化合物A是家用消毒剂的主要成分
|
请回答:
(1)元素T与X按原子个数比1:1形成的化合物B属于有?晶体。已知在通常条件下,39g B与足量CO2反应放出Q kJ的热量,写出该反应的热化学方程式?。
(2)将Y与Z形成的化合物的水溶液,逐滴加入到T的最高价氧化物对应水化物的溶液中直至过量(边滴加边振荡),此过程中实验现象?。
(3)已知1mol化合物A与Na2SO3在溶液中发生反应时,转移?mol电子
(4)在一定条件下,X、Y两种单质以及有孔惰性电极在化合物TZ的水溶液中可形成原电池,为新型海水航标灯提供能源,写出该原电池正极的电极反应式?。
参考答案:(1)离子(1分)?
2Na2O2(s)+ 2CO2(g) =2Na2CO3(s)+ O2(g);△H=–4Q kJ/mol ?(2分)?
(2)先无沉淀后有大量沉淀(1分)
(3)2(2分)
(4)O2 + 4e- + 2H2O =4OH- (2分)
本题解析:根据题中提供信息,T的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子,推断T为Na,X的原子最外层电子数是其内层电子数的三倍,X为O,在第三周期元素中,Y的简单离子半径最小,Y为Al,T、X、Z组成的36电子的化合物A是家用消毒剂的主要成分,可以联想84消毒液NaClO,符合36电子,Z为Cl。T与X按原子个数比1:1形成的化合物B为Na2O2,含有离子键、非极性共价键。Al元素最高价氧化物对应水化物Al(OH)3是两性氢氧化物,有两种电离方式,酸式电离和碱式电离。AlCl3逐滴加到NaOH溶液中,先没有沉淀,后出现沉淀。离子方程式为Al3++4OH-=AlO2-+2H2O,Al3+ + 3AlO2-+ 6H2O=4Al(OH)3↓。NaClO氧化Na2SO3,SO32- + ClO- =SO42- + Cl-转移2mol电子,NaClO被还原为Cl—,Al和O2在NaOH溶液中可以形成原电池,O2做正极,得电子生成OH—。
本题难度:简单
5、选择题 下列关于卤素(F、Cl、Br、I)的叙述中,正确的是?(?)
A.原子核外最外层电子数随原子序数的增大而增多
B.气态氢化物的稳定性随原子序数的增大而增强
C.原子半径随原子序数的增大而减小
D.氯水、溴水和碘水均能使淀粉碘化钾试纸变蓝
参考答案:D
本题解析:同主族元素的最外层电子数是相同的,自上而下原子半径逐渐增大,非金属性逐渐减弱,ABC不正确。氯水和溴水均能置换出碘化钾中的碘,所以选项D是正确的,答案选D。
本题难度:简单