|
高中化学知识点总结《反应速率与平衡的有关计算》在线测试(2017年最新版)(二)
2017-11-05 23:37:09
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、填空题 (14分)痛风是关节炎反复发作及产生肾结石为特征的一类疾病,关节炎的原因归结于在关节滑液中形成了尿酸钠(NaUr)晶体,有关平衡如下:
① HUr(尿酸,aq)  Ur-(尿酸根,aq) + H+(aq)?(37℃时,Ka =4.0×10-6) Ur-(尿酸根,aq) + H+(aq)?(37℃时,Ka =4.0×10-6)
②NaUr(s)  ?Ur-(aq) + Na+(aq) ?Ur-(aq) + Na+(aq)
(1)37℃时,0.5 L水中可溶解4.0×10-3 mol尿酸钠,此温度下尿酸钠的Ksp为? ▲?。
(2)关节炎发作大都在脚趾和手指的关节处,这说明温度降低时,反应②的Ksp? ▲?(填“增大”、“减小”或“不变”),生成尿酸钠晶体的反应是? ▲?(填“放热”或“吸热”)反应。
(3)37℃时,某病人尿液中尿酸分子和尿酸根离子的总浓度为2.0×10-3 mol·L-1,其中尿酸分子的浓度为4.0×10-4 mol·L-1,该病人尿液的pH为? ▲?。
(4)常温下,将0.2 mol·L-1的HUr溶液和0.1 mol·L-1 NaOH溶液等体积混合,若混合液体积等于两溶液体积之和,则混合液中下列关系正确的是? ▲?。
A.c(HUr) > c(Ur-)
B.pH > 7
C.c(Na+)=c(HUr)+c(Ur-)
D.2 c(H+)=2 c(OH-)+[c(Ur-) -c(HUr)]
| (5)试根据所学平衡知识说出一种防治关节炎的措施? ▲?。
(6)已知如图所示t1时刻在尿酸钠的饱和溶液(晶体充足)中加适量水,试作出V溶解、V沉淀与时间关系的示意图
参考答案:(14分)
(1)6.4×10-5 (2分)(2)减小(2分)?放热(2分)(3)6(2分)(4)A(2分)
(5)减少尿酸的产生或减少Na+的摄入(2分)
(6)
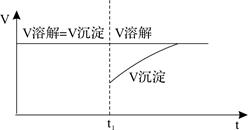 (2分) (2分)
本题解析:略
本题难度:简单
2、选择题 下列哪种说法可以证明反应N2 +3H2 2NH3已达到平衡状态(?) 2NH3已达到平衡状态(?)
A.1mol N≡N键断开的同时, 有6 mol H-N键生成
B.1 mol N≡N键断开的同时, 有6 mol H-N键断开
C.1 mol N≡N键生成的同时, 有3 mol H-H键生成
D.1 mol N≡N键断开的同时, 有3 mol H-H键断开
参考答案:B
本题解析:在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。选项A、C、D中反应速率的方向是相同的,速率之比是相应的化学计量数之比,因此A、C、D中的关系始终是成立,不正确;B中反应速率的方向相反,且满足速率之比是相应的化学计量数之比,正确,答案选B。
点评:该题是中等难度的试题,该题也是高考中的常见题型和考点。试题基础性强,难易适中,侧重对学生能力的培养和解题方法的指导与训练,有助于培养学生的逻辑推理能力和发散思维能力。该题的关键是明确平衡状态的特点,然后结合具体的可逆反应灵活运用即可。
本题难度:简单
3、选择题 在溶液中,反应A+2B C分别在三种不同实验条件下进行,它们的起始状态均为c(A)=0.100 mol·L-1、c(B)=0.200mol·L-1、c(C)=0 mol·L-1. 在三种条件下,反应物A的浓度随时间的变化如右图所示。 C分别在三种不同实验条件下进行,它们的起始状态均为c(A)=0.100 mol·L-1、c(B)=0.200mol·L-1、c(C)=0 mol·L-1. 在三种条件下,反应物A的浓度随时间的变化如右图所示。
下列说法中,正确的是
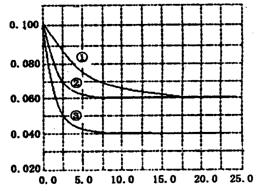
A.反应的平衡常数:①<②?
B.反应A+2B C的△H>0 C的△H>0
C.实验②平衡时B的转化率为60%
D.实验③平衡时c(C)=0.040 mol·L-1
参考答案:B
本题解析:略
本题难度:简单
4、计算题 在一定条件下将物质的量相等的NO和O2混合发生如下反应:2NO+O2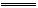 2NO2,2NO2 2NO2,2NO2 N2O4。所得混合气体中NO2的体积分数为40%,混合气体的平均相对分子质量。 N2O4。所得混合气体中NO2的体积分数为40%,混合气体的平均相对分子质量。
参考答案:49.6
本题解析:设起始NO物质的量为x:
?2NO+O2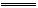 2NO2 则剩余O2的体积为: 2NO2 则剩余O2的体积为:
?2 1 2
?x x/2 x ?VO2=x/2mol
设生成的NO2有ymol转化成N2O4
? ?2NO2 N2O4 N2O4
?起始物质的量 ? x? ? ?0
?转化物质的量 ?2y ? ?y?
?平衡物质的量 ?x-2y? ?y?
混合气体总物质的量为
?n总=x-2y+y+(x/2)=x+(x/2)-y?
依题意有:(x-2y/x+(x/2)-y)=(40/100)
解得?x=4y
∴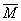 =(32×(x/2)+46(x-2y)+92×y/x+x/2-y) =(32×(x/2)+46(x-2y)+92×y/x+x/2-y)
=(64y+184y/5y)=49.6
本题难度:简单
5、简答题 将N2和H2按一定比例混合,在相同状况下其密度是H2的3.6倍,取出0.5mol该混合气体充入密闭容器里,使之发生反应并在一定条件下达到平衡,已知反应达平衡后容器内压强是相同条件下反应前压强的0.76倍,试求:(1)反应前混合气体中N2和H2的体积比;
(2)达到平衡时混合气体中N2的物质的量;
(3)平衡时N2的转化率.
参考答案:(1)N2和H2按一定比例混合,在相同状况下其密度是H2的3.6倍,则混合气体的平均相对分子质量=3.6×2=7.2,令0.5mol混合气体中N2和H2的物质的量分别为xmol、ymol,则:
本题解析:
本题难度:一般
| 