1、填空题 硝酸是一种重要的化工原料,工业上生产硝酸的主要过程如下:
(1)以N2和H2为原料合成氨气。一定温度下,在密闭容器中充入1molN2和3molH2发生反应。若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的11/12,则N2的转化率α1____________;若容器压强恒定,达到平衡状态时,N2的转化率为α2,则α2 _______α1(‘填“>”、“<”或“=”)。
(2)用氨催化氧化法可生产硝酸,其生产过程可表示为:
4NH3+5O2 4NO+6H2O,4NO+3O2+2H2O=4HNO3
4NO+6H2O,4NO+3O2+2H2O=4HNO3
现以5.1吨液氨为原料来生产质量分数为50%的硝酸,理论上需要加水的质量为_____________吨。(假设生产过程中反应物和生成物均无损耗)
(3)硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
2NO2+Na2CO3=NaNO2+NaNO3+CO2,NO+NO2+Na2CO3=2NaNO2+CO2。若在标准状况下有NO、NO2的混合气体(不考虑N2O4)恰好与50mL 1.0 mol·L-1的Na2CO3溶液反应完全,且生成NaNO2和NaNO3的物质的量的比为4:1,则在混合气体中NO气体的体积分数为多少?(请写出计算过程)
参考答案:(1)16.7%;>
(2)13.5
(3)由反应转化关系知,反应过程中钠元素守恒,设NaNO2和NaNO3的物质的量分别为4amol和amol,则4a+a=50mL×10-3mL·L-1×1.0mol·L-1×2,
解得:a=0.02mol,于是
推出NO、NO2的物质的量分别为:0.03mol、0.07mol,
即:NO所占的体积分数为30%。
本题解析:
本题难度:一般
2、选择题 对于3W(g) + 2X(g) = 4Y(g) + 3Z(g) ,下列反应速率关系正确的是
[? ]
A.υ(W) =3υ(Z)
B.2υ(X) =3υ(Z)
C.2υ(X) =υ(Y)
D.3υ(W) =2υ(X)
参考答案:C
本题解析:
本题难度:简单
3、计算题 (1)在硫酸生产中,SO2催化氧化生成SO3是反应的关键,其反应的化学方程式为: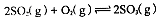 ,反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题:
,反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题:
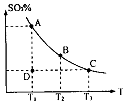
①反应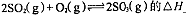 ?0(填“>”或“<”)。若在恒温恒容条件下,上述反应达到平衡,再给该平衡体系中通入SO3气体,容器内的压强?(填“增大”、“减小”或“不变”),平衡?移动(填“向正反应方何”、“逆反应方向’或“不”)若在恒温恒压条件下,上述反应达到平衡,再 给该平衡体系中通人大量氮气后,体系重新达到平衡,此平衡与原平衡相比较,SO2的物质的量?__(填“增大”、“减小”或“不变”),O2的物质的量浓度?(填“增大”、“减小”或“不变”)。
?0(填“>”或“<”)。若在恒温恒容条件下,上述反应达到平衡,再给该平衡体系中通入SO3气体,容器内的压强?(填“增大”、“减小”或“不变”),平衡?移动(填“向正反应方何”、“逆反应方向’或“不”)若在恒温恒压条件下,上述反应达到平衡,再 给该平衡体系中通人大量氮气后,体系重新达到平衡,此平衡与原平衡相比较,SO2的物质的量?__(填“增大”、“减小”或“不变”),O2的物质的量浓度?(填“增大”、“减小”或“不变”)。
②若温度为T1、 T2,反应的平衡常数分别为K1、K2?则K1?K2(填“>”、“<”或“=”),反应进行到D点状态时,V正?V逆(填“>”、“<”或“=”)
③在一个固定容积为5L的密闭容器中充入0.20 mol SO2和0.10 mol O2,在500℃开始反应,半分钟达到平衡,测得容器内含SO3 0.18 mol,则v(O2)=?mol·L-1·min-1,若继续通入0.20 mol SO2和0.10 mol O2,平衡发生了移动,再次达到平衡后,??mol<n(SO3)<?mol.
(2)已知三种无色溶液:a.NaHCO3溶液,b.AlCl3溶液,c.NaAlO2溶液,它们两两反应均能生成Al(OH)3沉淀。请回答下列问题:
①两种溶液恰好完全反应,所得溶液中c(OH—)=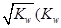 是水的离子积),则这两种溶液可为?(填字母)。
是水的离子积),则这两种溶液可为?(填字母)。
②能体现出NaHCO3在反应中,HCO—3的水解程度小于电离程度的离于方程式为?。
参考答案:(1)①<?增大?逆反应方向?增大?减小
②>? >?③0.036? 0.36? 0.40
(2)①b? c②HCO3-+AlO2-+H2O=Al(OH)3+CO32-
本题解析:(1)①升高温度,平衡向吸热反应方向移动。升高温度,SO3的百分含量减小,逆反应是吸热反应,则正反应是放热反应,
△H<0;再通入SO3,体系压强增大,又要重新达到平衡,平衡应该向逆反应方向移动;恒温恒压下,通入惰性气体,体系容积扩大,相当于压强减小,平衡向逆反应方向移动,SO2的物质的量增大,O2的浓度减小。②此反应正反应是放热反应,低温有利于平衡向正反应方向移动。而平衡常数是生成物浓度幂之积比反应物浓度幂之积,T2>T1,故K1>K2。D点不是平衡点,要达到平衡,SO3的百分含量要增大,故V正>V逆。③
2SO2+? O2 ?2SO3
?2SO3
起始:0.20? 0.10? 0
转化:0.18? 0.09? 0.18
平衡:0.20-0.18? 0.10-0.09? 0.18
v(O2)=0.09/5/0.5=0.036mol·L-1·min-1
可逆反应不能进行到底,故0.36mol<n(SO3)<0.40mol
(2)①“两种溶液恰好完全反应,所得溶液中c(OH—)=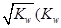 是水的离子积)”,说明反应后溶液呈中性,只能是AlCl3和NaAlO2混合;②NaHCO3与NaAlO2混合溶液呈碱性,说明HCO3-的水解程度小于电离程度。
是水的离子积)”,说明反应后溶液呈中性,只能是AlCl3和NaAlO2混合;②NaHCO3与NaAlO2混合溶液呈碱性,说明HCO3-的水解程度小于电离程度。
本题难度:困难
4、填空题 (14分)中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物,其主要为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
离子
| K+
| Na+
| NH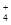
| SO
| NO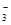
| Cl-
|
浓度/mol?L-1
| 4×10-6
| 6×10-6
| 2×10-5
| 4×10-5
| 3×10-5
| 2×10-5
|
根据表中数据计算PM2.5待测试样的pH = ? 。
(2) NOx是汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
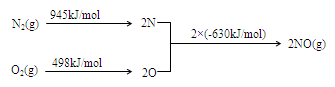
① N2(g)+O2(g) 2NO(g)△H=?。
2NO(g)△H=?。
②当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式?。
③ 汽车汽油不完全燃烧时还产生CO,有人设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g),已知该反应的△H>0,该设想能否实现??。
(3)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
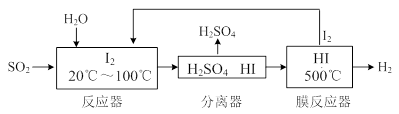
① 用离子方程式表示反应器中发生的反应 ? 。
② 用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是?。
③ 用吸收H2后的稀土储氢合金作为电池负极材料(用MH表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量、长寿命的镍氢电池。电池充放电时的总反应为:Ni(OH)2+M  ?NiO(OH)+MH,电池放电时,负极电极反应式为 ? ; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸。
?NiO(OH)+MH,电池放电时,负极电极反应式为 ? ; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸。
参考答案:⑴ 4?⑵① +183kJ/mol;② 2NO+2CO催化剂 2CO2+N2;③ 不能
⑶① SO2+I2+2H2O=SO +2I-+4H+?
+2I-+4H+?
②HI分解为可逆反应,及时分离出产物H2,有利于反应正向进行?
③MH+OH--e-=H2O+M
本题解析:(1)题目所示的微粒中阳离子所带的正电荷数是:4×10-6×1+6×10-6×1+2×10-5×1=3×10-5mol/L,阴离子所带的负电荷总数是:2×4×10-5+1×3×10-5+1×2×10-5=13×10-5 mol/L>3×10-5mol/L,根据溶液呈电中性原理,溶液中还应该含有大量的H+。所以溶液显酸性。c(H+)=13×10-5 mol/L-3×10-5mol/L=1×10-4 mol/L,所以pH="4." (2)①反应热就是断裂化学键吸收的热量与形成化学键释放的热量的差值。因此 N2(g)+O2(g 2NO(g)△H=+945KJ/mol+498KJ/mol-2×630KJ/mol=+183KJ/mol。②NO被CO还原的化学方程式为2NO+2CO催化剂 2CO2+N2;③由于该反应是体系混乱程度减小的吸热反应,体系的自由能大于0,所以设想是不能实现的。① 根据图示可知:用离子方程式表示反应器中发生的反应是:SO2+I2+2H2O=SO
2NO(g)△H=+945KJ/mol+498KJ/mol-2×630KJ/mol=+183KJ/mol。②NO被CO还原的化学方程式为2NO+2CO催化剂 2CO2+N2;③由于该反应是体系混乱程度减小的吸热反应,体系的自由能大于0,所以设想是不能实现的。① 根据图示可知:用离子方程式表示反应器中发生的反应是:SO2+I2+2H2O=SO +2I-+4H+。②2HI(g)
+2I-+4H+。②2HI(g) H2(g)+I2(g). HI分解反应是可能反应。在反应中使用膜反应器分离出H2,减小生成物的浓度,平衡正向移动,有利于反应正向进行。③根据总反应方程式可知:在电池放电时,负极电极反应式为MH+OH--e-=H2O+M。2.5的溶液的酸碱性、热化学方程式与化学键的关系、浓度对平衡移动的影响、离子方程式的书写、镍氢电池的电极反应式的书写的知识。
H2(g)+I2(g). HI分解反应是可能反应。在反应中使用膜反应器分离出H2,减小生成物的浓度,平衡正向移动,有利于反应正向进行。③根据总反应方程式可知:在电池放电时,负极电极反应式为MH+OH--e-=H2O+M。2.5的溶液的酸碱性、热化学方程式与化学键的关系、浓度对平衡移动的影响、离子方程式的书写、镍氢电池的电极反应式的书写的知识。
本题难度:一般
5、选择题 已知,I2(aq)+I-(aq) I3-(aq)。某I2、、KI混合溶液中,c(I3-)与温度(T)的关系如下图所示(曲线上任何一点都表示平衡状态)。下列说法中,正确的是
I3-(aq)。某I2、、KI混合溶液中,c(I3-)与温度(T)的关系如下图所示(曲线上任何一点都表示平衡状态)。下列说法中,正确的是
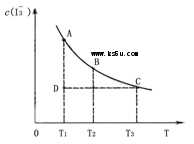
A.反应 I2(aq)+I-(aq)  I3-(aq)的△H>0
I3-(aq)的△H>0
B.状态A的c(I2)比状态D的小
C.A点对应的反应速率大于C点对应的反应速率
D.其他条件不变,向溶液中加入KI固体,平衡由C点移动到D点
参考答案:B
本题解析:
正确答案:B
A、不正确,从图得出,温度升高,I3―浓度变小,平衡逆向移动,△H小于0;
B.正确;
C.不正确,A点对应的反应速率不于C点对应的反应速率,A点温度低;
D.不正确,其他条件不变,向溶液中加入KI固体,不衡正向移动,平衡由C点移动到A点;
本题难度:一般