1、选择题 常温下,四个容积为20 L的容积中分别装有质量相同的下列气体,容器中产生的压强最大的是(?)
A.H2
B.HCl
C.SO2
D.CO2
参考答案:A
本题解析:略
本题难度:简单
2、实验题 (18分).某同学需要用到85 mL 1 mol/L的NaCl溶液,现需在实验进行配制,填空并请回答下列问题:
(1)配制1 mol/L的NaCl溶液
托盘天平称取NaCl的质量
| 应选用容量瓶的规格(可供选择的规格100 mL、250 mL、500 mL)
| 除容量瓶外还需要的其它仪器
|
|
|
|
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) __ ______;
A、用30 mL水洗涤烧杯内壁和玻璃棒2—3次,洗涤液均注入容量瓶,振荡
B、用托盘天平准确称取所需NaCl的质量,将量好的NaCl倒入烧杯中,再加入少量水(约30 mL),用玻璃棒慢慢搅动,使其混合均匀
C、将NaCl沿玻璃棒注入容量瓶中
D、将容量瓶盖紧,振荡,摇匀
E、继续往容量瓶内小心加水,直到溶液凹面恰好与刻度相切
(3)指出本实验的操作错误的地方,并进行更正。
。
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”):
①若加蒸馏水时不慎超过了刻度 ;
②若定容时俯视刻度线___________________;
③C操作中不小心洒出有溶液 。
(5)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度线一点点 ;
参考答案:(18分)(1)
托盘天平称取NaCl的质量
应选用容量瓶的规格(可供选择的规格100 mL、250 mL、500 mL)
除容量瓶外还需要的其它仪器
5.9
100 mL
烧杯、玻璃棒、胶头滴管、量筒
(2) BCAED
(3) E,继续往容量瓶内小心加水到溶液离刻度线1~2 cm处,改用胶头滴管滴加水至凹液面恰好与刻度线相切
(4)① 偏低 ;②偏高 ③ 偏低 (5) 重新配制
本题解析:考查一定物质的量浓度溶液的配制以及有关误差分析等。
(1)由于没有85ml容量瓶,所以需要配制100ml溶液,则需要氯化钠的质量是0.1L×1 mol/L×58.5g/mol=5.85g=5.9g;溶解时需要烧杯、量筒和玻璃棒,定容时还需要胶头滴管,所以还缺少的其它仪器是烧杯、玻璃棒、胶头滴管、量筒。
(2)根据配制原理以及实验要求可知,配制时,正确的操作顺序是BCAED。
(3)定容时必须使用胶头滴管,使用E是错误的,因此正确的操作应该是继续往容量瓶内小心加水到溶液离刻度线1~2 cm处,改用胶头滴管滴加水至凹液面恰好与刻度线相切。
(4)根据c=n/V可知,如果若加蒸馏水时不慎超过了刻度,则容量瓶中溶液的体积偏大,浓度就偏低;若定容时俯视刻度线,则容量瓶中溶液的体积偏少,因此浓度就偏高;转移操作中不小心洒出有溶液,则溶质减少,使用浓度偏低。
(5)若实验过程中加蒸馏水时不慎超过了刻度线一点点,则此时实验已经失败,只能是重新配制。
本题难度:一般
3、选择题 配制一定物质的量浓度的稀盐酸时,最后用胶头滴管向容量瓶滴加蒸馏水,由于不慎,液面超过了容量瓶颈上的刻度,这时应采取的措施是(?)
A.用胶头滴管吸出超过的那一部分
B.把溶液倒出一部分在蒸发皿中,蒸发一部分水后把蒸发皿中剩余的溶液仍注入容量瓶,重新加水至刻度
C.根据超出的蒸馏水量,经过计算,补加浓盐酸
D.把容量瓶中的溶液全部弃去,重新配制。
参考答案:D
本题解析:液面超过了容量瓶颈上的刻度,这时应采取的措施是把容量瓶中的溶液全部弃去,重新配制,答案选D。
点评:该题是高考中的常见考点,属于基础性试题的考查。该题的关键是明确物质的量浓度溶液配制的原理、操作注意事项,然后灵活运用即可,有利于培养学生的规范严谨的实验设计能力和动手操作能力。
本题难度:一般
4、选择题 设NA为阿伏加德罗常数的值,下列有关叙述不正确的是
A.标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为7/22.4NA
B.1 mol甲基(—CH3)所含的电子总数为9NA
C.0.5 摩1, 3-丁二烯分子中含有C=C双键数为 NA
D.1 mol碳正离子(CH+ 3)所含的电子总数为8NA
参考答案:A
本题解析:标准状况下,庚烷为液态,所以不能以气体的摩尔体积来计算,故答案为A
本题难度:一般
5、选择题 NA表示阿伏加德罗常数的值。下列说法正确的是( )
A.常温下,5.6 g Fe投入足量浓硝酸中,转移电子数目为0.3NA
B.1 L 1 mol/L Na2CO3溶液中含有C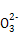 数目为NA
数目为NA
C.标准状况下,2.24 L CO和CO2混合气体中含有的碳原子数目为0.1NA
D.标准状况下,11.2 L CH3CH2OH中含有的分子数目为0.5NA
参考答案:C
本题解析:常温下,Fe在浓HNO3中钝化,无法求算其转移的电子数,A项错误;C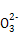 水解,故1 L 1 mol/L Na2CO3溶液中的C
水解,故1 L 1 mol/L Na2CO3溶液中的C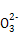 数目小于NA,B项错误;标准状况下,2.24 L即0.1 mol CO和CO2混合气体中含C原子数目为0.1×NA,C项正确;CH3CH2OH在标准状况下是液体,无法用气体摩尔体积求算其分子数,D项错误。
数目小于NA,B项错误;标准状况下,2.24 L即0.1 mol CO和CO2混合气体中含C原子数目为0.1×NA,C项正确;CH3CH2OH在标准状况下是液体,无法用气体摩尔体积求算其分子数,D项错误。
本题难度:简单