1、选择题 向明矾溶液里加入Ba(OH)2溶液,待SO42-沉淀完全时,铝元素的存在形式是
[? ]
A.一部分为Al(OH)3沉淀,一部分以Al3+形式存在于溶液中
B.一部分为Al(OH)3沉淀,一部分以AlO2-形式存在于溶液中
C.全部为Al(OH)3沉淀
D.几乎全部以AlO2-形式存在于溶液中
参考答案:D
本题解析:
本题难度:简单
2、填空题 ( 14分)(I )某校化学兴趣小组用如下图所示过程除去AlCl3中含有的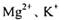 杂质离子并尽可能减少AlCI3的损失:请回答下列问题:
杂质离子并尽可能减少AlCI3的损失:请回答下列问题:
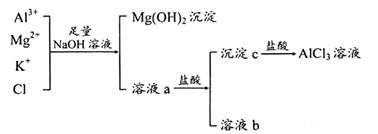
①写出混合物屮加人足虽氢氧化钠溶液时.溶液屮发生反应的离.子方程式:__________
②溶液a中存在的阴离子有__________;在溶液a中加人盐酸时需控制溶液的PH的原因是__________为此改讲方法是_______________
(2 )该化学小组又测定一定质量的某镁铝混合物中镁的质量分数,设计了如下实验方案:
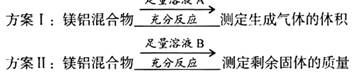
下列有关判断中不正确的是()(填代号)
A.溶液A选用NaOH溶液
B.若溶液B选用浓硝酸.则测得镁的质量分数偏小
C.溶液A和B均可选用稀硝酸
D.实验室屮方案II更便于实施
参考答案:

本题解析:略
本题难度:一般
3、选择题 把0.1mol铝投入到。 100mL3mol/L的.NaOH溶液中充分反应后,再滴人lmol/L的H2SO4120mL,其结果(? )
100mL3mol/L的.NaOH溶液中充分反应后,再滴人lmol/L的H2SO4120mL,其结果(? )
A.溶液的pH<7
B.得到澄清透明溶液
C.有沉淀生成
D.先有白色沉淀生成,后逐渐溶解
参考答案:C
本题解析:略
本题难度:一般
4、选择题 在两份体积相同的氢氧化钠和稀硫酸溶液中分别加入过量铝粉,充分反应后,在相同状况下,若放出氢气的体积相同,则该氢氧化钠溶液与硫酸溶液的物质的量浓度之比为( )
A.3:1
B.1:3
C.2:3
D.3:2
参考答案:令生成的氢气的物质的量为3mol,则:
2Al+3H2SO4=2Al2(SO4)3+3H2↑
3mol 3mol
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2mol 3mol
氢氧化钠和稀硫酸溶液的体积相等,所以所取氢氧化钠和稀硫酸溶液的浓度比等于溶质NaOH、H2SO4的物质的量的之比,即为2mol:3mol=2:3.
故选C.
本题解析:
本题难度:简单
5、选择题 下列有关物质的性质和该性质的应用均正确的是
A.SiO2具有较好的导电性,可用于制造半导体材料
B.H2O2是一种绿色氧化剂,可氧化酸性高锰酸钾而产生O2
C.铜的金属活动性比铁弱,可用铜罐代替铁罐贮运浓硝酸
D.Mg在空气中燃烧发出耀眼的白光,可用于制作信号弹
参考答案:D
本题解析:A、硅单质具有较好的导电性,可用于制造半导体材料,二氧化硅可以用光导纤维,A不正确;B、H2O2是一种绿色氧化剂,也具有还原性,能被酸性高锰酸钾氧化而产生O2,B不正确;C、浓硝酸在常温下能氧化金属铜,因此不能用铜罐代替铁罐贮运浓硝酸,C不正确;D、Mg在空气中燃烧发出耀眼的白光,可用于制作信号弹,D正确,答案选D。
本题难度:一般