|
高中化学知识点归纳《热化学方程式》高频试题特训(2017年最新版)(六)
2017-11-05 23:45:24
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、填空题 把煤作为燃料可通过下列两种途径:
途径I: C(s)+O2(g) = CO2(g)
途径II:先制水煤气: C(s) + H2O(g) =" CO(g)" + H2(g)
燃烧水煤气:2 CO(g) + O2(g) = 2CO2(g);
2H2(g)+O2(g) =2H2O(g)
已知:①C(s)+O2(g)=CO2(g);△H1=-393.5 kJ·mol-1
②H2(g)+1/2O2(g)=H2O(g);△H2=-241.8kJ·mol-1
③CO(g)+ 1/2O2 (g) =CO2(g);△H3=-283.0kJ·mol-1
请回答下列问题:
(1)CO(g) + H2O(g) = H2(g) + CO2(g) 是 (填“放热反应”或“吸热反应”)
(2)根据盖斯定律,煤和气态水生成水煤气的反应热△H= 。
(3)根据两种途径,下列说法错误的是( )
A.途径II制水煤气时增加能耗,故途径II的做法不可取
B.与途径I相比,途径II可以减少对环境的污染
C.与途径I相比,途径II可以提高煤的燃烧效率
D.将煤转化为水煤气后,便于通过管道进行运输
|
参考答案:(1)放热反应
(2)131.3kJ/mol
(3)A
本题解析:(1)③-②可得目标方程式的热效应,ΔH=-283.0kJ·mol-1-(-241.8kJ·mol-1)<0,所以该反应为放热反应;
(2)根据盖斯定律,煤和气态水生成水煤气的反应热△H=①-②-③=-393.5 kJ·mol-1-(-241.8kJ·mol-1)-(-283.0kJ·mol-1)=131.3kJ/mol
(3)A、根据盖斯定律,无论是途径I还是途径II,最终碳燃烧的热效应是相同的,错误;B、碳直接燃烧会造成燃烧不充分,且产物中可能含二氧化硫,给大气带来污染,正确;C、与途径I相比,途径II燃料燃烧充分可以提高煤的燃烧效率,正确;D、将煤转化为水煤气后,便于通过管道进行运输,正确,答案选A。
考点:考查盖斯定律的应用,反应热的计算,燃料燃烧的分析判断
本题难度:一般
2、选择题 已知H-H键能436kJ/mol;Cl-Cl键能243kJ/mol;H-Cl键能431kJ/mol,则下列热化学方程式正确的是( )
A.H2(g)+Cl2(g)=2HCl(g)△H=-183?kJ/mol
B. H2(g)+Cl2(g)=HCl(g)△H=-124kJ/mol
C.2HCl(g)=H2(g)+Cl2(g)△H=-248?kJ/mol
D.HCl(g)=H2(g)+Cl2(g)△H=-91.5?kJ/mol
参考答案:反应为H2(g)+Cl2(g)=2HCl(g),反应的焓变=436kJ/mol+243kJ/mol-2×431kJ/mol=-183KJ/mol;
A、H2(g)+Cl2(g)=2HCl(g)△H=-183 kJ/mol,热化学方程式正确,故A正确;
B、系数减少一倍,焓变减少一倍,焓变应为-92,5KJ/mol,故B错误;
C、热化学方程式改变方向,焓变符号也要改变,焓变应为正值为183KJ/mol,故C错误;
D、依据分析热化学方程式方向改变,焓变符号改变应为正值,数值为原来的一半,故D错误;
故选A.
本题解析:
本题难度:简单
3、选择题 化学反应N2+3H2===2NH3的能量变化如下图所示,该反应的热化学方程式是

[? ]
A.N2(g)+3H2(g)===2NH3(l) ΔH=2(a-b-c)kJ/mol
B.N2(g)+3H2(g)===2NH3(g) ΔH=2(b-a)kJ/mol
C.1/2N2(g)+3/2H2(g)===NH3(l) ΔH=(b+c-a)kJ/mol
D.1/2N2(g)+3/2H2(g)===NH3(g) ΔH=(a+b)kJ/mol
参考答案:A
本题解析:
本题难度:简单
4、选择题 下列说法正确的是
[? ]
A.可以用乙醇萃取溴水中的溴单质
B.表示甲醇燃烧热的热化学方程式为2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H=-362.88 kJ/mol
C.加入稀硝酸和BaCl2溶液产生白色沉淀的溶液中一定含SO42-
D.玻璃棒在配制0.1 mol/L NaCl溶液与粗盐提纯的实验中所起的作用相同
参考答案:D
本题解析:
本题难度:简单
5、填空题 已知:
N2H4(g)+O2=N2(g)+2H2O(g) ΔH=-543kJ/mol
1/2H2(g)+1/2F2(g)=HF(g) ΔH=-269kJ/mol? ΔH=-242kJ/mol
请写出N2H4和F2反应的热化学方程式:__________________________________________ 。
参考答案: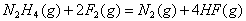 ? ΔH=-1135kJ/mol ? ΔH=-1135kJ/mol
本题解析:
本题难度:一般
|