|
高考化学知识点总结《离子共存》在线测试(2017年最新版)(八)
2017-11-05 23:48:56
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、填空题 (11分)2010年春至2013年连续四年发生在云南省的严重旱情牵动了全国人民的心,引起人们对水资源的再次重视。水是组成生命体的重要化学物质,有关水的反应有很多。
(1)用电子式表示H2O的形成过程 。
(2)在pH=1的水溶液中,①NH4+、Al3+、Br-、SO42- ② Na+、Fe2+、Cl-、NO3-
③K+、Ba2+、Cl-、NO3- ④K+、Na+、HCO3-、SO42-四组离子中,一定大量共存的是 (填序号)。
(3)在下列反应中,水仅做氧化剂的是 (填字母,下同),水既不做氧化剂又不做还原剂的是 。
A.2F2+2H2O=4HF+O2
B.2Na2O2+2H2O=4NaOH+O2↑
C.CaH2+2H2O=Ca(OH)2+2H2↑
D.3Fe+4H2O Fe3O4+4H2 Fe3O4+4H2
| (4)“神舟七号”飞船上的能量主要来自于太阳能和燃料电池,H2、O2和KOH的水溶液可形成氢氧燃料电池,负极的电极反应为 ,反应产生的水经冷凝后可作为航天员的饮用水,当得到1.8 L饮用水时,电池内转移的电子数约为 。
参考答案:(1)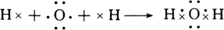 (2分) (2分)
(2)①③ (2分) (3)CD (2分) B(1分)
(4)H2+2OH?—2e?=2H2O (2分) 200NA(2分)
本题解析:(1)H2O为共价化合物,各原子达到稳定结构,用电子式表示形成过程为: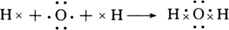
(2)①pH=1的溶液呈酸性,各离子互不反应,可以大量共存;②酸性溶液中,NO3?、H+与Fe2+发生氧化还原反应,不能大量共存;③各离子互不反应,可以大量共存;④HCO3?与H+反应,不能大量共存。
(3)A、2F2+2H2O=4HF+O2, 依据化合价变化,水中O元素化合价升高,水做还原剂;B、2Na2O2+2H2O=4NaOH+O2↑,据化合价变化,此反应是过氧化钠的自身氧化还原反应,水既不是氧化剂也不是还原剂;C、CaH2+2H2O=Ca(OH)2+2H2↑,依据化合价变化,水中的氢元素化合价降低,水做氧化剂;D、3Fe+4H2O(g) Fe3O4+4H2,依据化合价的变化,水中的氢元素化合价降低,水做氧化剂;所以水仅做氧化剂的是CD,水既不做氧化剂又不做还原剂的是B。 Fe3O4+4H2,依据化合价的变化,水中的氢元素化合价降低,水做氧化剂;所以水仅做氧化剂的是CD,水既不做氧化剂又不做还原剂的是B。
(4)负极上H2失去电子,电极方程式为:H2+2OH?—2e?=2H2O;H2O的密度约为100g/L,所以1.8 L H2O的物质的量为:1800g÷18g/mol=100mol,根据电池总反应2H2+O2=2H2O可得对应关系:H2O ~ 2e?,所以电子转移为200mol,数目为200NA。
考点:本题考查电子式、离子共存、氧化还原反应原理、原电池原理。
本题难度:一般
2、选择题 在强酸性溶液中能大量共存的无色透明离子组是( )
A.K+、Na+、NO3-、MnO4-
B.Mg2+、Na+、Cl-、SO42-
C.K+、Na+、Cl-、Cu2+
D.Na+、Ba2+、OH-、SO42-
参考答案:A、MnO4-离子有颜色,不符合题目无色的要求,故A错误;
B、在酸性条件下本选项中四种离子不发生任何反应,能大量共存,且溶液无色,符合题目要求,故B正确;
C、Cu2+离子有颜色,不符合题目无色的要求,故C错误;
D、OH-与H+离子发生反应的离子不能大量共存,Ba2+与SO42-反应生成沉淀而不能大量共存,故D错误.
故选B.
本题解析:
本题难度:一般
3、选择题 甲、乙、丙、丁四种易溶于水的物质,分别由NH4+、Ba2+、Mg2+、H+、OH-、Cl-,HCO3-、SO42-中的不同阳离子和阴离子各一种组成,已知;①将甲溶液分别与其他三种物质的溶液混合,均有白色沉淀生成;②0.1 mol/L乙溶液中c(H+)>0.1 mol/L;③向丙容器中滴入AgNO3溶液有不溶于稀硝酸的白色沉淀生成,下列结论不正确的是(?)
A.甲溶液含有Ba2+
B.乙溶液含有SO42-
C.丙溶液含有Cl-
D.丁溶液含有Mg2+
参考答案:D
本题解析:解答本题应注意以下两点:(1)抓住关键信息②确定乙是H2SO4。
(2)利用信息①③确定NH4+必须与HCO3-结合与Ba(OH)2反应才能产生白色沉淀,故甲是Ba(OH)2,丙是MgCl2,丁是NH4HCO3。
本题难度:一般
4、选择题 下列各组离子一定能大量共存的是(?)
A.在含有大量[Al(OH)4]-的溶液中:NH4+、Na+、Cl-、H+
B.在强碱溶液中:Na+、K+、CO32-、NO3-
C.在pH=12的溶液中:NH4+、Na+、SO42-、Cl-
D.在c(H+)=0.1mol·L-1的溶液中:K+、I-、Cl-、NO3-
参考答案:B
本题解析:选项A中〔AlOH4〕-与H+不能共存;选项C中pH=12,则c(OH-)=0.01mol·L-1,NH4+与OH-不能共存;选项D中溶液呈酸性,NO3-在酸性溶液中具有强氧化性,与具有还原性的I-不能共存。
本题难度:一般
5、选择题 下列各组离子一定能大量共存的是( )
A.在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN-
B.在强碱溶液中:Na+、K+、AlO2-、CO32-
C.在c(H+)=10—13 mol/L的溶液中:NH4+、Al3+、SO42-、NO3-
D.在pH=1的溶液中:K+、Fe2+、Cl—、NO3—
参考答案:B
本题解析:A.Fe3+和SCN- 不能共存,错误;C.在c(H+)=10—13 mol/L的溶液是碱性溶液,NH4+和氢氧根不能共存,错误;D.在pH=1的溶液中,溶液显酸性,Fe2+与NO3—会发生氧化还原反应,不能共存。
本题难度:一般
|