1、选择题 在2SO2(g)+O2(g)  2SO3(g) 的平衡体系中,当分离出SO3时,下列说法中正确的是(?)?
2SO3(g) 的平衡体系中,当分离出SO3时,下列说法中正确的是(?)?
A.正反应速率增大
B.平衡向逆反应方向移动
C.正反应速率大于逆反应速率
D.逆反应速率一直减小
参考答案:C
本题解析:
正确答案:C
A.不正确,正反应速率减小;B.不正确,生成物浓度减小,平衡向正反应方向移动?
C.正确,正反应速率大于逆反应速率,平衡正确向移动;D.不正确,逆反应速率达到新平衡后不再减小。
本题难度:一般
2、填空题 接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:2SO2(g)+O2(g) 2SO3(g);△H=-190kJ·mol-1
2SO3(g);△H=-190kJ·mol-1
(1)该热化学反应方程式的意义是___________________________________________________________________________________ ___。升高温度上述反应平衡常数____(填“变大”“变小”或“不变”)。
(2)下列描述中能说明上述反应已达平衡的是________。
a.v(O2)正=2v(SO3)逆
b.容器中气体的平均相对分子质 量不随时间而变化
c.容器中气体的密度不随时间而变化
d.容器中气体的分子总数不随时间而变化
(3)在一个固定容积为5 L的密闭容器中充入0.20 mol SO2和0.10 mol O2,半分钟后达到平衡,测得容器中含SO3 0.18 mol,则v(O2)=__________mol·L-1·min-1;若继续通入0.20 mol SO2和0.10 mol O2,则平衡________________移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,________mol<n(SO3)<________mol。
参考答案:(1) 在450℃时,2 mol SO2(g)和1 mol O2(g)完全反应生成2 mol SO3(g)时放出的热量为190 kJ;变大
(2) bd?
(3) 0.036;向正反应方向;0.36;0.40
本题解析:
本题难度:一般
3、填空题 (12分)
(1)在密闭容器里,通入x mol SO2和y mol O2,发生化学反应:2SO2 (g) + O2 (g) 2SO3 (g) ;当其它条件不变时,改变下列条件,反应速率将如何改变?(填“增大”“减小”或“不变”)
2SO3 (g) ;当其它条件不变时,改变下列条件,反应速率将如何改变?(填“增大”“减小”或“不变”)
①降低温度____________________ ;?
②当容器容积不变,充入更多的O2 ____________________ ;?
③当容器容积不变,通入氖气____________________。
(2)来自石油的基本化工原料苯和乙烯,都有着十分广泛的用途。请回答:
④可以用来鉴别苯蒸气和乙烯的试剂是____________________(填序号)。
A.水? B.溴的四氯化碳溶液? C.酸性高锰酸钾溶液
⑤苯分子具有平面正六边形结构,所有原子共一个平面,则苯分子中在一条直线上的原子最多有____________________ 个。
⑥在一定条件下,乙烯能与水发生加成反应生成有机物A,写出A与Na反应的化学方程式________________________________________。
参考答案:(每空2分,共12分)
(1)①减小?②增大?③不变
(2)④ABC (选1项不计分,选2项给1分,全部选对且未多选给2分);
⑤4?⑥2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
本题解析:略
本题难度:一般
4、选择题 在445℃的密闭容器中,分别加入0.1 mol/LH2和I2,发生反应H2+I2(g)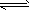 2HI,定时测定反应体系中各物质的浓度,记录数据如下表
2HI,定时测定反应体系中各物质的浓度,记录数据如下表

下列说法错误的是
[? ]
A.30 s内用H2表示的平均反应速率v(H2)=0.002 mol/(L·s)
B.60 s时,其他条件不变,将容器体积迅速压缩到原来的一半,则c(HI)>0. 312 mol/L
C.在其他条件不变时,升高体系温度,气体颜色变浅,则该反应正反应为吸热
D.c1<0.156 mol/L,c2=0.156 mol/L
参考答案:B
本题解析:
本题难度:一般
5、填空题 已知T K和P kPa时,在容积为V L的密闭容器中充有1 mol A和1 mol B,保持恒温恒压,使反应: A(g)+B(g) C(g)达到平衡时, C的体积分数为40%。试完成下列有关问题:
C(g)达到平衡时, C的体积分数为40%。试完成下列有关问题:
(1)若使温度和压强在上述条件下恒定不变,在密闭容器中充入2 mol A和2 mol B,则反应达到平衡时,容器的体积为________,C的体积分数为________。
(2)若另选一容积固定不变的密闭容器,仍然控制温度为T K,使1 mol A和1 mol B反应达到平衡状态时, C的体积分数仍然为40%,则该密闭容器的体积为________。
参考答案:(1)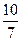 V L? 40%?(2)
V L? 40%?(2)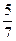 V L
V L
本题解析:恒温恒压时保持某物质成分的体积分数不变,允许所有的物质成倍改变,所加入物质成倍改变后,平衡状态时体系的体积也成倍改变,所以先计算出加入1 mol A和1 mol B后达到平衡状态时体系的体积为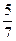 V L,则当加入2 mol A和2 mol B时达到平衡状态后体系的体积必然为
V L,则当加入2 mol A和2 mol B时达到平衡状态后体系的体积必然为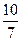 V L。当反应在固定体积的容器中反应时,只有一开始体积就是平衡状态时的体积,才能满足平衡时C的体积分数不变。
V L。当反应在固定体积的容器中反应时,只有一开始体积就是平衡状态时的体积,才能满足平衡时C的体积分数不变。
本题难度:简单