1、选择题 下列微粒中,与氩原子具有相同电子层结构的是( )
A.Na+
B.
C.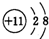
D.Ne
参考答案:A.Na+离子结构示意图为: ,钠离子核外有10个电子,与Ne原子电子层结构相同,故A错误;
,钠离子核外有10个电子,与Ne原子电子层结构相同,故A错误;
B.氯离子结构示意图为: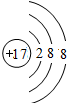 ,核外有18个电子,与氩的电子层结构相同,故B正确;
,核外有18个电子,与氩的电子层结构相同,故B正确;
C.Na+离子结构示意图为: ,所以该示意图为钠离子,核外有10电子,与Ne原子电子层结构相同,故C错误;
,所以该示意图为钠离子,核外有10电子,与Ne原子电子层结构相同,故C错误;
D.Ne原子核外有10个电子,故D错误;
故选B.
本题解析:
本题难度:简单
2、选择题 以下有关元素性质的说法不正确的是( )
A.具有下列电子式的原子中,①1s22s22p63s23p2②1s22s22p3③1s22s22p2④1s222s2p63s23p4原子半径最大的是①
B.下列原子的价电子排布中,①3s23p1②3s23p2③3s23p3④3s23p4对应的第一电离能最大是③
C.①Na,K,Rb②N,P,As③O,S,Se④Na,P,Cl元素的电负性随原子序数增大而递增的是④
D.某元素的逐级电离能分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X3+
参考答案:D
本题解析:
本题难度:一般
3、简答题 已知元素周期表中共有18纵行,如图实线表示元素周期表的边界,按电子排布,可把周期表划分为s区、p区、d区、ds区等.除ds区外,其他区的名称均按构造原理最后填入电子的能级符号来命名.
(1)请在图中用实线画出s区、p区、d区、ds区的边界线,并标记分区______.
(2)有的同学受这种划分的启示,认为d区内6、7纵行的部分元素可以排在另一区,你认为应排在______区.
(3)请在元素周期表中标出4s轨道半充满的元素(用元素符号表示).
(4)随着科学技术的发展,不断有新的元素被发现.若把第七周期排满,则元素周期表共可以排布______种元素.
(5)在周期表中,电负性最大的元素是______,该元素的原子轨道图______.写出该单质与水反应的化学方程式:______.
参考答案:(1)ⅠA、ⅡA族最后填充s电子,为s区;ⅢA~零族为p区,第ⅢB~ⅤⅡB族和第ⅤⅢ为d区;ⅠB和ⅡB族为ds区,如图所示为
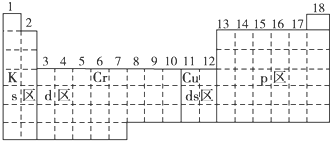
,
故答案为:

;
(2)区内6、7纵行的部分元素,d轨道半满,s电子半满或全满,为稳定结构,与ds区元素的稳定结构相似,则可以排在ds区,故答案为:ds;
(3)Cr的外围电子排布为3d54s1,为4s轨道半充满;Cu的外围电子排布为3d104s1,为4s轨道半充满,所以4s轨道半满的为Cr和Cu,位置见(1)中答案,
故答案为:

;
(4)第一周期有2种元素,第二、三周期各有8种元素,第四、五周期各有18种元素,第六、七周期排满各为32种,则排满时元素共有2+8+8+18+18+32+32=118种,
故答案为:118;
(5)周期表中F的电负性最大,F的原子轨道图为

,氟与水反应生成HF和氧气,该反应为2F2+2H2O═4HF+O2,
故答案为:F;

;2F2+2H2O═4HF+O2.
本题解析:
本题难度:一般
4、选择题 下列叙述正确的是( )
A.H2与12H的核外电子数相同
B.Cl和Cl-核外电子层数不同
C.在CS2、PCl3中各原子最外层均能达到8电子的稳定结构
D.Ar原子的结构示意图为:
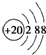
参考答案:A、H2是分子,核外共有2个电子,12H是原子,核外只有1个电子,故A错误;
B、Cl和Cl-都有3个电子层,故B错误;
C、判断达8电子的方法:原子最外层电子数+化合价的绝对值=8就达8电子,否则不是;根据上述方法判断知,CS2和PCl3中各原子最外层均能达到8电子的稳定结构,故C正确;
D、Ar原子的结构示意图应为
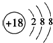
,故D错误;
故选C.
本题解析:
本题难度:一般
5、简答题 (1)基态氮原子的价电子排布式是______.氮气分子中含有一个______键,二个______键.
(2)白磷分子的空间构型为______,若将1分子白磷中的所有P-P键打开并各插入一个氧原子,共可结合______个氧原子,若每个P原子上的孤对电子分别再以配位键连接一个氧原子,就可以得到磷的另一种氧化物______(填分子式).
(3)金刚石的晶体结构中每个碳原子与周围的4个碳原子形成四个碳碳单键,这5个碳原子形成的是______结构,金刚石晶体中C原子数与C-C键数之比为______,晶体中最小的环上的碳原子数为______.
参考答案:(1)N原子的原子序数为6,基态氮原子的价电子排布式是1s22s22p3,氮气的结构式为N≡N,含有1个δ键,2个π键,
故答案为:1s22s22p3;δ;π;
(2)白磷为正四面体结构,含有6个共价键,若将1分子白磷中的所有P-P键打开并各插入一个氧原子,共可结合6个O原子,若每个P原子上的孤对电子分别再以配位键连接一个氧原子,还可结合4个O原子,则可形成化合物P4O10,
故答案为:正四面体;6;P4O10;
(3)金刚石晶体中每个C原子处于其他4个C原子构成的正四面体的内部,向周围无限延伸形成空间立体网状结构,最小的环是立体六元环,每个C原子周围有4条共价键,而每2个碳原子形成1个共价键,则金刚石晶体中C原子数与C-C键数之比为1:2,
故答案为:正四面体;1:2;6.
本题解析:
本题难度:一般