1、选择题 下列物质中,含有共价键的离子化合物是( ? )
A.H2SO4
B.MgCl2
C.Na2O
D.NaOH
参考答案:D
本题解析:
本题难度:简单
2、选择题 下列叙述正确的是
[? ]
A.原子晶体中可能存在离子键
B.分子晶体中不可能存在氢键
C.在晶体中可能只存在阳离子不存在阴离子
D.金属晶体导电是金属离子所致
参考答案:C
本题解析:
本题难度:简单
3、填空题 卤族元素是典型的非金属元素,包括F、Cl、Br、I等。请回答下面有关问题
(1)同主族元素的电负性大小存在一定的规律,卤族元素F、Cl、Br、I的电负性由小到大的顺序是_____。
(2)Br原子的M层核外电子排布式为_________。
(3)用价层电子对互斥理论判断BeCl2的构型为________,BF3分子中B-F键的键角为________。
(4)CCl4分子中碳原子的杂化方式为______,NF3分子的空间构型为_______。
(5)F、Mg、K三种元素形成的晶体晶胞结构如图所示,一个晶胞中 Mg元素的质量分数为________。
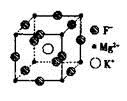
参考答案:(1)I Br Cl F
(2)3s23p63d10
(3)直线型? 120。
(4)sp3?三角锥形
(5)20%
本题解析:(1)非金属性越强,电负性越大,即电负由小到大的顺序是I Br Cl F;
(2)Br是第四周期元素,其M层电子排布式为3s23p63d10
(3)BeCl2中含有的孤对电子对数是(2-2×1)/2=0,所以BeCl2是直线型。BF3是平面正三角型,键角是120。
(4)CCl4是正四面体,C原子采取的是sp3杂化;N原子含有孤对电子对数是=(5-3×1)/2=1,且AB3型,所以NF3是三角锥型。
(5)该晶胞中含Mg(8×1/8)=1个,K原子个数为1,F原子数为12×1/4=3,所以其化学式为KMgF3,由化学式可算出Mg的质量分数为20%
本题难度:一般
4、选择题 下列说法中正确的是
[? ]
A.分子的结构是由键角决定的
B.共价键的键能越大,共价键越牢固,由该键形成的分子越稳定
C.CF4、CCl4、CBr4、CI4中C—X键的键长、键角均相等
D.H2O分子中两个O—H键的键角为180°
参考答案:B
本题解析:
本题难度:简单
5、选择题 下列对一些实验事实的理论解释正确的是? ( )。
选项
| 实验事实
| 理论解释
|
A
| 氮原子的第一电离能大于氧原子
| 氮原子2p能级半充满
|
B
| CO2为直线形分子
| CO2分子为非极性分子
|
C
| 金刚石的熔点低于石墨
| 石墨熔融时除了破坏共价键,还需破坏范德华力
|
D
| HF的沸点高于HCl
| H-F的键能大于H-Cl
参考答案:A
本题解析:CO2分子是非极性分子,B不正确;石墨中碳碳键的键长短,作用力强,所以石墨的熔点高于金刚石的,C不正确;D不正确,由于HF分子间存在氢键引起的,答案选A。
点评:在比较晶体额熔沸点时,首先分清楚晶体类型,然后在根据相应的要求逐一进行比较。
本题难度:一般
|