1、简答题 K分别代表有关反应的一种反应物或生成物,其中A、C、F、K是固体,且A是一种不含金属元素的盐,受热分解能得到三种物质的量相等的产物,A加热后生成的气体混合物若通过碱石灰,只剩余气体B(B为无色有刺激性气味的气体),若通过浓硫酸则只剩余气体D,回答列问题:
(1)写出C的电子式______.
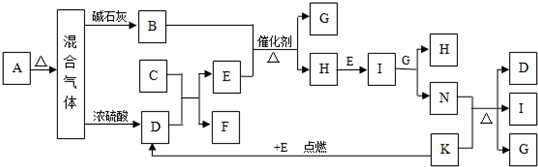
(2)写出固体A的溶液与足量NaOH溶液反应的离子方程式
(3)写出实验室制取B的化学方程式
(4)写出N与K反应方程式
(5)火星探测车在火星大气中检测到了气体M.资料显示,M分子是三原子分子,其相对分子质量为60,在地球环境下M易分解.粉末状的KSCN与浓硫酸在一定条件下可得到气体M和两种硫酸氢盐,生成物的物质的量之比是1:1:1.则气体M的结构式是______.
参考答案:A是一种不含金属元素的盐,受热分解能得到三种物质的量相等的产物,推断A为NH4HCO3,A加热后生成的气体混合物若通过碱石灰,只剩余气体B(B为无色有刺激性气味的气体)推断为,NH3,若通过浓硫酸则只剩余气体D,判断D为CO2;结合转化关系B+E在催化剂作用下加热生成G+H,H能发生连续反应,说明是氨气的催化氧化反应判断E为O2,G为H2O,H为NO,I为NO2N为HNO3,D(CO2)+C=E(O2)+F,判断C为Na2O2,F为Na2CO3,依据转化关系K+E(O2)=D(CO2)反应是点燃条件下发生的反应,判断K为C,所以依据反应N(HNO3)+K(C)=D(CO2)+I+G(H2O)推断I为NO2;
(1)C为过氧化钠,电子式为:
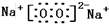
,故答案为:
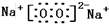
;
(2)固体A为碳酸氢铵的溶液与足量NaOH溶液反应的离子方程式为:NH4++HCO3-+2OH-=H2O+CO32-+NH3?H2O,故答案为:NH4++HCO3-+2OH-=H2O+CO32-+NH3?H2O;
(3)实验室制取B为NH3的化学方程式为:Ca(OH)2+2NH4Cl??△?.??CaCl2+2H2O+2NH3↑,故答案为:Ca(OH)2+2NH4Cl??△?.??CaCl2+2H2O+2NH3↑;
(4)N为HNO3与K(C)反应方程式为:C+4HNO3?△?.?4NO2↑+CO2↑+2H2O,故答案为:C+4HNO3?△?.?4NO2↑+CO2↑+2H2O;
(5)M分子是三原子分子,其相对分子质量为60,在地球环境下M易分解.粉末状的KSCN与浓硫酸在一定条件下可得到气体M和两种硫酸氢盐,生成物的物质的量之比是1:1:1.则气体M的结构式是S=C=O;由题意可知,反应的化学方程式为KSCN+H2O+2H2SO4=KHSO4+NH4HSO4+A,由质量守恒可知A为SCO,结构式为S=C=O,
故答案为:S=C=O;
本题解析:
本题难度:一般
2、填空题 A、B、C、D、G?都是含有同一种短周期元素的化合物,E?是氧化物,H?是单质.根据如图转化关系(反应条件及部分产物已略去)填空:
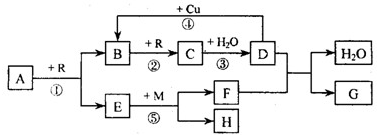
(?l?)若A、B、C、D、G?均含X?元素,且A的一个分子中只含有10?个电子,G?是复合肥料,则反应①、②、③是工业生产______的基本原理,M?的化学式是______.其中反应①的化学方程式是______;反应④的离子方程式是______.
(?2?)若A、B、C、D、G?均含Y元素,Y元素处于X的相邻周期、相邻族,G?可作净水剂,则反应①、②、③是工业生产______的基本原理,M?元素在周期表中的位置是______.其中反应①的化学方程式是______;反应①一⑤中,既属于化合反应又属于非氧化还原反应的是______.
参考答案:(1)E是氧化物,由A和R反应生成,则R应为O2,A的一个分子中只含有10个电子且能连续氧化,则A为NH3,B是NO,E是H2O,C是NO2,D是HNO3;由于G是复合肥料,只能是KNO3,故F为KOH,H为H2,M为K.则反应①、②、③是工业生产硝酸的重要反应,其中反应①的化学方程式是4NH3+5O2催化剂.△4NO+6H20,反应④是铜和稀硝酸的反应,其离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,故答案为:硝酸;?K(或K2O2、KO2);4NH3+5O2催化剂.△4NO+6H20;3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;?
(2)Y元素处于X的相邻周期、相邻族,说明Y元素是S元素,位于第3周期ⅢA族,故B为SO2,C为SO3,D为H2SO4,反应①是工业生产硫酸的反应,可推知A为FeS2,E为Fe2O3,反应方程式为:4FeS2+11O2?高温?.?2Fe2O3+8SO2;G可作净水剂,为Al2(SO4)3,M为Al,Al位于第3周期ⅢA族,H为Fe,F为Al2O3,在以上反应中C→D的反应为S03+H20═H2SO4,为非氧化还原反应,故答案为:硫酸;第3周期ⅢA族;4FeS2+11O2?高温?.?2Fe2O3+8SO2;③.
本题解析:
本题难度:一般
3、推断题 A、B、C、D、E、F、G、H、I、J有如图所示的转化关系。
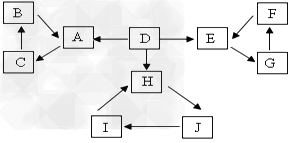
图中所有物质均有短周期元素组成,且每个小三角形内的三种物质均至少含有第三周期中的一种相同元素。其它信息见下表
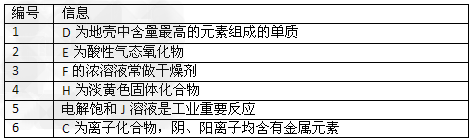
(1)写出G的化学式________,指出H中化学键类型________________
(2)常温下测得一定浓度的C溶液的PH=10,用离子方程式表示其原因_____________。
(3)写出与H式量相同,且它们的阴离子所含的电子数、电荷数也均相同的化合物的电子式________________。
(4)写出C溶液中通入过量CO2的化学方程式________________。
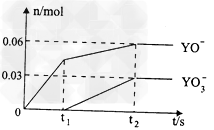
(5)电解饱和J溶液产物之一为Y2,将一定量的Y2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中三种含Y元素的离子,其中两种离子物质的量(n)与反应时间(t)的变化示意图如上图所示,写出该反应的离子方程式是________________________,该苛性钾溶液中KOH的质量________________。
参考答案:(1)SO2或H2SO3;“略”
(2)AlO2-+2H2O Al(OH)3+3OH-
Al(OH)3+3OH-
(3)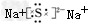
(4)CO2 + NaAlO2 + 2H2O = NaHCO3 + Al(OH)3↓
(5)5Cl2+10OH-=2ClO-+ ClO3-+7Cl-+5H2O;16.8g
本题解析:
本题难度:一般
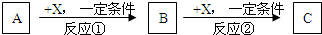
4、填空题 A、B、C、X均为常见的纯净物,它们之间有如下转化关系(副产品已略去).
试回答:
(1)若X是强氧化性单质,则A不可能是______.
a.S?b.N2?c.Na?d.Mg?e.Al
(2)若X是金属单质,向C的水溶液中滴入AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的化学式为______;C溶液在贮存时应加入少量X,理由是(用必要的文字和离子方程式表示)______.检验此C溶液中金属元素价态的操作方法是______.
(3)若A、B、C为含某金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式为______,X的化学式可能为(写出不同类物质)______或______.反应①的离子方程式为______.
参考答案:(1)若X是强氧化性单质,由转化关系AX
本题解析:
本题难度:一般
5、简答题 用右图所示装置进行实验,将A逐滴加入B中;
(1)若A为浓硫酸,B为第三周期金属元素的片状单质,其在常温下难与水反应;C为品红溶液,实验中观察到溶液褪色,则B是______(写化学式),B与浓H2SO4反应的化学方程式为______;反应后往烧杯中加入沸水,又可观察到试管C中的现象为______.
(2)若B为Na2CO3,C为C6H5ONa溶液,实验中观察到小试管内溶液变浑浊,则酸A应具有的性质是______.然后往烧杯中加入沸水,可观察到试管C中的现象是______.
(3)若B是生石灰,实验中观察到C溶液先形成沉淀,然后沉淀溶解,当溶液恰好澄清时,关闭E,然后往烧杯中加入热水,静置片刻,观察到试管壁出现光亮的银镜,则A是______(写名称),C是______(写化学式)与葡萄糖的混合液.该反应的离子方程式为______,仪器D在此实验中的作用是______.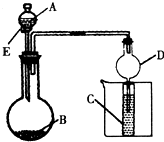
参考答案:(1)由题意可知,B为第三周期金属元素的片状单质,其在常温下难与水反应,B可能为铝活着镁,但浓硫酸常温下会使铝钝化,所以B只能为镁,与浓硫酸发生氧化还原反应,反应的方程式为Mg+2H2SO4(浓)=MgSO4+SO2↑+2H2O,SO2具有漂白性,可使品红褪色,但不稳定,加热又能恢复到原来的颜色,
故答案为:Mg;Mg+2H2SO4(浓)=MgSO4+SO2↑+2H2O;C中溶液变红;
(2)观察到小试管内溶液变浑浊,说明生成二氧化碳,则A的酸性应比碳酸的酸性强,生成苯酚易溶于热水,加热溶液变澄清,
故答案为:酸性比碳酸的酸性强;溶液由浑浊变澄清;
(3)试管壁出现光亮的银镜,说明生成氨气,可用浓氨水或铵盐的浓溶液与生石灰反应制取,C中应为葡萄糖与银氨溶液的反应,则C中应为AgNO3和葡萄糖的混合液,加热时发生:CH2OH(CHOH)4CHO+2[Ag(NH3)2]++2OH-水溶
本题解析:
本题难度:一般