?
参考答案:(1) H+、SO42-;? Mg2+;? OH-、SO32-、HCO3-、Cu2+、Ba2+ Ag+、NO3-
(2) OH-、Ba2+;? NO3-;? Mg2+、Cu2+、H+、Ag+、SO42-、SO32-、HCO3-
本题解析:复习巩固铝的化学性质——既能与酸反应又能与碱反应,复习离子共存的知识。适合于中等学生。根据铝的化学性质,与金属铝反应放出H2,有两种情况:酸溶液或强碱溶液。因此:(1)肯定存在H+、SO42-;Mg2+与题意不冲突,属可能存在的离子;SO32-、HCO3-、OH-与H+不共存,Ba2+、SO42-、SO32-不共存,Cu2+显蓝色,NO3-存在,则相当与硝酸溶液,而硝酸与金属反应一般不生成氢气而是NO,所以这些离子均肯定不存在。
(2)肯定存在OH-、Ba2+;NO3-与题意不冲突,属可能存在的离子;HCO3-、H+、Ag+、Mg2+与OH-不共存,SO42-、SO32-与Ba2+不共存,Cu2+有色,所以这些离子均肯定不存在。
本题难度:简单
2、选择题 在下列各溶液中,离子一定能大量共存的是
[? ]
A. 强碱性溶液中:K+、Al3+、Cl-、SO42-
B. 含有0.1 mol/L Fe3+的溶液中:K+、Mg2+、I-、NO3-
C. 含有0.1 mol/L Ca2+的溶液中:Na+、K+、CO32-、Cl-
D. 室温下,pH=1的溶液中:Na+、Fe3+、NO3-、SO42-
参考答案:D
本题解析:
本题难度:一般
3、选择题 下列有关平衡常数的说法正确的是(?)
A.已知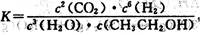 ,则对应的化学反 应可以表示为: ,则对应的化学反 应可以表示为:
2CO2( g) + 6H2(g) CH3CH2OH(g) + 3H2O(g) CH3CH2OH(g) + 3H2O(g)
B.将某浓度氢氟酸溶液升高温度,氢氟酸的电离平衡常数Ka将变大
C.常温下,向纯水中加入碳酸钠,水的电离程程度变大,Kw变大
D.化学平衡常数K与温度有关,随温度的升高,K可能增大也可能减小,或者不变
参考答案:B
本题解析:A 错误,平衡常数是平衡时生成物浓度幂的乘积比反应物浓度幂的乘积
B 正确,氢氟酸的电离是吸热反应,升温,平衡右移,电离平衡常数Ka将变大
C 错误,碳酸跟离子水解促进水的电离,但Kw只跟温度有关,所以Kw不变
D 错误,化学平衡常数K与温度有关,随温度的升高,K可能增大也可能减小,但不可能不变。
本题难度:简单
4、选择题 在下列给定条件的溶液中,一定能大量共存的离子组是
参考答案:D
本题解析:略
本题难度:一般
5、选择题
A.H3O+、NO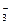 、Fe2+、Na+ 、Fe2+、Na+
B.Ag+、NO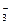 、Cl-、K+ 、Cl-、K+
C.K+、Ba2+、OH-、SO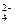
D.Cu2+、NH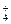 、Br-、OH- 、Br-、OH-
参考答案:A
本题解析:离子共存问题是历年常考题。离子之间只要能发生反应就不能共存,但解此题要注意题给条件:因发生氧化还原反应而不能大量共存。NO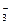 在酸性条件下能把Fe2+氧化为Fe3+,所以H3O+、NO 在酸性条件下能把Fe2+氧化为Fe3+,所以H3O+、NO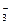 、Fe2+三者不能共存。答案为A,而B、C、D均因生成沉淀不能共存,但不属氧化还原反应,故不符合题意。 、Fe2+三者不能共存。答案为A,而B、C、D均因生成沉淀不能共存,但不属氧化还原反应,故不符合题意。
本题难度:一般
|