1、计算题 将15.6g Na2O2与2.7g Al粉混合后,投入足量的水中,充分反应(设能产生的气体全部放出)。
(1)Na2O2与水反应的化学方程式为?,15.6g Na2O2在该反应中转移电子的物质的量为??mol。
(2)反应结束时生成的气体在标准状况下为??L。
(3)取a g Na2O2与Al粉组成的混合物,放入适量的水中,固体完全溶解,在标准状况下
放出气体V L,则V的取值范围是?(用含a的代数式表示,结果可不化简)。
参考答案:(1)(2分)2Na2O2+2H2O=4NaOH+O2↑;(2分)0.2mol (2)(2分)5.6L?
(3)(4分)
本题解析:15.6g Na2O2的物质的量为0.2mol;2.7g Al的物质的量为0.1mol;
(1)Na2O2与水反应的化学方程式为:2Na2O2+2H2O=4NaOH+O2↑;1mol Na2O2与水反应转移的电子数为1mol;所以,15.6g Na2O2在该反应中转移电子的物质的量为0.2mol;
(2)15.6g Na2O2与水反应生成0.4mol氢氧化钠,生成0.1mol氧气;生成的氢氧化钠与AL反应的方程式为: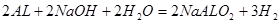 ,所以2.7g Al粉反应后生成氢气0.15mol;所以反应结束时生成的气体在标准状况下为5.6L;
,所以2.7g Al粉反应后生成氢气0.15mol;所以反应结束时生成的气体在标准状况下为5.6L;
(3)
本题难度:简单
2、选择题 下列物质中,碱性最强的是?
A.CsOH
B.KOH
C.NaOH
D.LiOH
参考答案:A
本题解析:同主族元素,自上而下金属性增强,对应最高价氧化物的水化物的碱性越强,故答案为A
本题难度:简单
3、计算题 某天然碱可以看作是CO2和NaOH反应后的产物组成的一种物质。为了测定该物质的成分,进行如下实验:⑴称取3.32g天然碱样品,加入30mL过量稀盐酸,产生672mL CO2气体(标准状况);⑵另称取3.32g天然碱样品,在300℃下加热至分解完全,产生CO2 112mL(标准状况)和0.45g水。试通过计算,确定天然碱的化学式。
参考答案:2Na2CO3·NaHCO3·2H2O
本题解析:略
本题难度:一般
4、选择题 下列说法正确的是( )
A.有些活泼金属如铝可用作热还原法的还原剂
B.用电解NaCl溶液的方法来冶炼金属钠
C.可用焦炭或一氧化碳还原氧化铝的方法来冶炼铝
D.使元素由化合态转化成游离态的过程就是还原的过程
参考答案:A
本题解析:A、有些活泼金属如铝可用作热还原法的还原剂,如铝热反应,正确;B、冶炼金属钠用电解熔融NaCl的方法,错误;C、冶炼铝用电解熔融氧化铝的方法,不可用焦炭或一氧化碳还原氧化铝的方法,错误;D、使元素由化合态转化成游离态的过程可能是氧化过程,也可能是还原的过程,错误。
本题难度:一般
5、填空题 (10分)钠和铝是两种重要的金属。请回答:
(1)钠元素的金属性比铝的?(填“强”或“弱”);常温下,可用?(填“钠”或“铝”)制成的容器盛装浓硫酸或浓硝酸。
(2)将一小块金属钠投入水中,发生反应的化学方程式为?;可观察到的实验现象是?(填序号)。
a.钠沉到水底? b.钠熔成小球? c.小球四处游动
(3)铝与氢氧化钠溶液反应的离子方程式为?。
参考答案:(1)强?铝?(2)2Na? +? 2H2O? ="?" 2NaOH? + H2 ↑
b c? (3)2Al+2OH-+2H2O==2AlO2- +? 3H2↑
本题解析:略
本题难度:一般