1、填空题 Ⅰ.用MnO2氧化密度为1.19 g·cm-3,溶质质量分数为36.5%的HCl溶液。反应的化学方程式为:
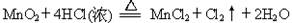
(1)该盐酸的物质的量浓度为 mol/L。
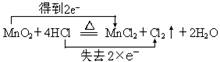
(2)用双线桥法表示出该反应的电子转移方向和数目 。
(3)8.7gMnO2能使 molHCl被氧化。
Ⅱ.在一定体积的18 mol/L的浓硫酸中加入过量铜片,加热使之反应,若被还原
的硫酸为 0.9 mol。则浓硫酸的实际体积_________(填“大于”、“等于”或“小于”)100mL。若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为________________________________________________。
参考答案:Ⅰ(1)11.9
(2)
(3)0.2
Ⅱ 大于 3Cu+8H++2NO3-=3Cu2++2NO +4H2O
本题解析:Ⅰ.(1)有公式c="1000pw/M=1000×1.19×36.5%/36.5=11.9" mol/L;
(2)
(3)在反应中MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
1mol MnO2氧化2mol浓盐酸,所以8.7gMnO2能使0.2molHCl被氧化.
Ⅱ.已知反应 Cu+2H2SO4 CuSO4+2H2O+SO2 ↑硫酸有一半被还原所以硫酸总物质的量为2×0.9="1.8(mol)"
CuSO4+2H2O+SO2 ↑硫酸有一半被还原所以硫酸总物质的量为2×0.9="1.8(mol)"
又知,硫酸的物质的量浓度为18mol/L ;所以原体积为1.8/18=0.1L;参加反应H2SO4为0.9mol×2=1.8mol,体积100mL,因反应后稀H2SO4不与Cu反应,故H2SO4体积应大于100mL。加入硝酸盐后,相当于铜与稀硝酸反应,3Cu+8H++2NO3-=3Cu2++2NO +4H2O
考点:实验室制取氯气的反应,及铜与浓硫酸的反应
本题难度:一般
2、选择题 下列化学用语正确的是:
A.HF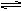 H++F-? B
H++F-? B . CO32-+2H2O
. CO32-+2H2O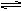 H2CO3+OH-
H2CO3+OH-
C.H2S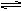 2H++S2-? D.NaHSO4(熔融)= Na++H++SO42-
2H++S2-? D.NaHSO4(熔融)= Na++H++SO42-
参考答案:A
本题解析:略
本题难度:简单
3、实验题 (7分)海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:
(1)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是_____________________。
(2)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为_________________,
由此反应可知,除环境保护外,在工业生产中应解决的主要问题是: _________________。
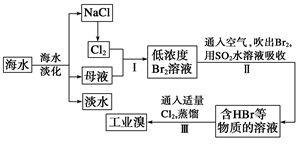
(3)兰州一中某化学研究性学习小组为了了解从工业溴中提纯溴的方法,查阅了有关资料知:Br2的沸点为59 ℃,微溶于水,有毒并有强腐蚀性。他们参观生产过程后,画了如下装置简图:
请你参与分析讨论:
①图中仪器B的名称是__________。
②实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件? ____________________。
参考答案:(1) 富集溴元素;(2)Br2+SO2+2H2O===4H++SO +2Br-;强酸对设备的严重腐蚀;
+2Br-;强酸对设备的严重腐蚀;
(4)①冷凝管;②控制温度计b的温度,并收集59 ℃的馏分
本题解析:(1)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是富集溴元素;(2)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为Br2+SO2+2H2O===4H++SO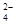 +2Br-;由上反应可知,除环境保护外,在工业生产中应解决的主要问题是强酸对设备的严重腐蚀;(3)①图中仪器B的名称是冷凝管;②由于Br2的沸点为59 ℃,所以实验装置气密性良好,要达到提纯溴的目的,操作中要控制温度计b的温度,并收集59 ℃的馏分。
+2Br-;由上反应可知,除环境保护外,在工业生产中应解决的主要问题是强酸对设备的严重腐蚀;(3)①图中仪器B的名称是冷凝管;②由于Br2的沸点为59 ℃,所以实验装置气密性良好,要达到提纯溴的目的,操作中要控制温度计b的温度,并收集59 ℃的馏分。
本题难度:一般
4、计算题 (6分)钙元素是人体必需的常量元素,所有的细胞都需要钙元素。正常人体血液含Ca2+为2.2×10-3 ~2.7×10-3mol·L-1。现抽取某人血样10ml。稀释后用草酸铵[(NH4)2C2O4]溶液处理,使Ca2+完全转变为草酸钙CaC2O4沉淀;过滤,洗涤,将得到的沉淀用稀硫酸溶解可得到草酸(H2C2O4),并用2.0ml 5.0×10-3 mol·L-1KMnO4溶液与溶解得到的草酸恰好完全反应。据此可以求此人血液中的Ca2+的浓度,并判断其血液含钙量是否正常。(提示2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2+8H2O)
(1)配制5.0×10-3 mol·L-1KMnO4 200mL溶液,需要称取KMnO4固体的质量是 g;
(2)每消耗草酸0.5mol,转移电子的物质的量为 mol;
(3)此人血液中的Ca2+的浓度为 mol·L-1。
参考答案:(各2分)(1)0.158 (2)1 (3)2.5×10-3
本题解析:(1)n(KMnO4)= 5.0×10-3 mol·L-1×0.2L=10-3 mol,KMnO4的质量为10-3 mol×158g/mol=0.158g。(2)反应2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2+8H2O转移的电子为10e-,所以每消耗草酸0.5mol,转移电子的物质的量为1mol 。(3)根据反应方程式和元素守恒可得到关系式:2KMnO4~5H2C2O~5CaC2O4,消耗了2.0ml 5.0×10-3 mol·L-1KMnO4溶液,则CaC2O4的物质的量为:25×10-6mol,血样取了10ml,所以Ca2+的浓度为:25×10-3 mol÷(10×10-3)=2.5×10-3mol·L-1
考点:物质的量的计算、氧化还原反应的电子转移、元素守恒规律的应用。
本题难度:一般
5、选择题 下列有关化学用语表示正确的是
A.中子数为18的硫原子: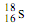
B.COCl2的电子式: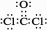
C.Al3+的结构示意图: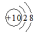
D.聚丙烯的结构简式: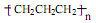
参考答案:B
本题解析:A、中子数为18的硫原子符号为34 16S,错误;B、正确;C、Al3+的结构示意图中圈中的数字为质子数应为13,错误;D、主链应是两个碳原子,错误。
本题难度:一般