|
高中化学知识点讲解《化学平衡》试题巩固(2017年最新版)(四)
2017-11-11 01:33:46
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、选择题 在密闭的容器中进行如下反应:H2(g)+I2(g)  2HI(g),在温度T1和T2时,产物的量和时间的关系如图所示,根据图像判断正确的是 ( ) 2HI(g),在温度T1和T2时,产物的量和时间的关系如图所示,根据图像判断正确的是 ( )
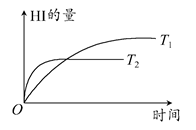
A.T1<T2,ΔH<0
B.T1>T2,ΔH<0
C.T1<T2,ΔH>0
D.T1>T2,ΔH>0
|
参考答案:A
本题解析:由图像可知,温度为T2时达到化学平衡所需的时间短,表明温度T2>T1,从T1→T2表示升温,达到平衡时HI的量降低,表明升温平衡逆向移动,正反应是放热反应,即ΔH<0,故选A。
本题难度:一般
2、填空题 (1)一定条件下的密闭容器中,反应3H2(g)+3CO(g) CH3OCH3(二甲醚)(g)+CO2(g) ΔH<0达到平衡,要提高CO的转化率,可以采取的措施是 (填字母代号)。 CH3OCH3(二甲醚)(g)+CO2(g) ΔH<0达到平衡,要提高CO的转化率,可以采取的措施是 (填字母代号)。
a.升高温度 b.加入催化剂 c.减小CO2的浓度 d.增加CO的浓度 e.分离出二甲醚
(2)已知反应②2CH3OH(g) CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下: CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质
| CH3OH
| CH3OCH3
| H2O
| 浓度/(mol·L-1)
| 0.44
| 0.6
| 0.6
|
①比较此时正、逆反应速率的大小:v(正) v(逆)(填“>”“<”或“=”)。
②若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH)= ;该时间内反应速率v(CH3OH)= 。
参考答案: (1)c、e (2)①> ②0.04 mol·L-1 0.16 mol·(L·min)-1
本题解析: (1)正反应是放热反应,升高温度平衡左移,CO转化率减小;加入催化剂,平衡不移动,转化率不变;减少CO2的浓度、分离出二甲醚,平衡右移,CO转化率增大;增大CO浓度,平衡右移,但CO转化率降低,故选c、e。
(2)此时的浓度商Qc==1.86<400,反应未达到平衡状态,向正反应方向移动,故v(正)>v(逆);设平衡时生成物的浓度为(0.6 mol·L-1+x),则甲醇的浓度为(0.44 mol·L-1-2x),根据平衡常数表达式400=,解得x=0.2 mol·L-1,故0.44 mol·L-1-2x=0.04 mol·L-1。
由表可知,甲醇的起始浓度为(0.44+1.2) mol·L-1=1.64 mol·L-1,其平衡浓度为0.04 mol·L-1,10 min内变化的浓度为1.6 mol·L-1,故v(CH3OH)=0.16 mol·(L·min)-1。
考点:平衡常数、平衡移动
本题难度:一般
3、填空题 已知反应:3I-(aq)+S2O82-(aq) I3-(aq)+2SO42-(aq); ? I3-(aq)+2SO42-(aq); ?
(1)写出反应的平衡常数表达式: K=_____________。
(2)下图表示反应过程中有关物质的能量,则反应的△H______0(填>、<、=)。
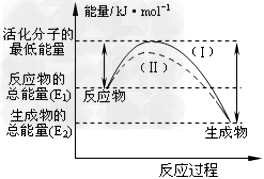
(I)、(II)两线中,使用催化剂的是________线。 ?
(3)反应中发生反应的I-与被氧化的I-的物质的量比为___________。 ?
(4)反应的速率可以用I3-与加入的淀粉溶液反应是蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,记录的数据如下
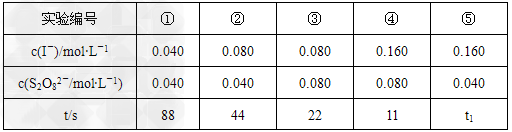
则:该实验的目的是______________。显色时间t1=__________。分析表中数据,得出的结论是_________________________。
参考答案:(1)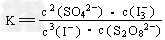
(2)<;(II)
(3)3:2
(4)研究I-、S2O82-浓度对反应速率的影响;22;反应速率与反应物浓度乘积成正比
本题解析:
本题难度:一般
4、填空题 (14分)低碳生活(low-carbon life)是一种时尚的生活理念,倡导人们降碳节能、有效幵发利用CO2。
(1) 若用如图装置,以CO2和H2为原料制备甲醇,发生反应为 。H2应从电解池的________ (填电极名称)通入;其中b电极的电极反应方程式为________。 。H2应从电解池的________ (填电极名称)通入;其中b电极的电极反应方程式为________。

(2) 工业上可在6500C浮石银催化作用下用甲醇制备甲醛。当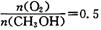 时,制备反应分两步进行,其中一步是 时,制备反应分两步进行,其中一步是  ,则另一步是____________ (写化学方程式)。 ,则另一步是____________ (写化学方程式)。
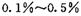 的HCHO可用于杀菌消毒,其原因是________。 的HCHO可用于杀菌消毒,其原因是________。
(3) 最近有人利用ZrO2作为固体电解质制造出了常温下的甲醇一空气燃料电池。当原电池中有0. 5 mol甲醇消耗时,产生最大电能为360. 0 kJ。则负极消耗O2—的物质的量为________mol;若该燃料电池所产生的最大电能与甲醇常温下燃烧所释放的全部能量之比为9: 10,则CH3OH燃烧的热化学方程式为________;在O2不足时原电池会发生负极区固体电解质堵塞,导致堵塞的物质是________。
参考答案:(1)阳极? CO2+6H++6e-=CH3OH+H2O
(2)CH3OH HCHO+H2?甲醛能使蛋白质变性 HCHO+H2?甲醛能使蛋白质变性
(3)1.5?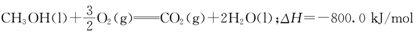 ?碳粒 ?碳粒
本题解析:(1)氢气在反应中失去电子,应在阳极通入。B是电子流入的极是属于阴极,电极反应式为CO2+6H++6e-=CH3OH+H2O。
(2)甲醇脱去1分子氢气即得甲醛,方程式为CH3OH HCHO+H2。因为甲醛可以使蛋白质变性,所以可用于杀菌消毒。 HCHO+H2。因为甲醛可以使蛋白质变性,所以可用于杀菌消毒。
(3)0. 5 mol甲醇在反应中失去3mol电子(碳原子由—2价升高到+4价),根据电子得失守恒知负极消耗O2—的物质的量为1.5mol。0. 5 mol甲醇常温下燃烧所释放的能量是400kJ,所以热化学方程式为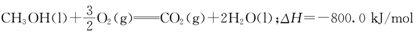 。若氧气不足即相当于燃烧不充分,容易使甲醇被氧化生成碳,从而产生堵塞现象。 。若氧气不足即相当于燃烧不充分,容易使甲醇被氧化生成碳,从而产生堵塞现象。
本题难度:一般
5、选择题 将1molCO和1molH2O充入容器中,在催化剂存在下发生反应H2O?(g)+CO(g)?

H2?(g)+CO2(g)
达到平衡时,发现有50%的CO转化为CO2.在其他条件不变的情况下,若将1molCO和2molH2O充入反应器中,则反应达平衡后,混合气体中CO2的体积分数可能为( )
A.
B.
C.
D.
参考答案:由到平衡时,发现有50%的CO转化为CO2,则
? H2O?(g)+CO(g)?

H2?(g)+CO2(g)
开始1? 1? 0? 0
转化?0.5? 0.5? 0.5?0.5
平衡?0.5? 0.5? 0.5?0.5
则CO2的体积分数为0.50.5+0.5+0.5+0.5=14,
若将1molCO和2molH2O充入反应器,CO的转化率为100%,则
? ?H2O?(g)+CO(g)?

H2?(g)+CO2(g)
开始2? 1? 0? 0
转化?1? 1? ?1? 1
平衡?1?0? 1? ?1
CO2的体积分数为11+0+1+1=13,
即CO的转化率介于50%--100%之间,所以CO2的体积分数介于14--13之间,
29介于16--13之间,故选C.
本题解析:
本题难度:一般
|