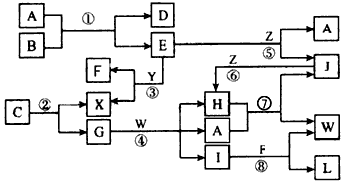
1、推断题 下图表示各物质之间的转化关系。
已知:
Ⅰ.A是无色气体,L是不溶于稀硝酸的白色沉淀,E、F、H、J、X、Y、Z是气体;
Ⅱ.G、X、Y、Z是单质,其余是化合物,其中Y呈黄绿色、H晕红棕色,E和F都极易溶解于水,二者相遇会有白烟生成;
Ⅲ.B和C都是由一种金属与一种非金属元素组成的化合物,其中非金属元素相同且质量分数都是28%,组成B的金属元素原子核处的K层和M层电子数相同。
请按要求填空:
(1)写出下列物质的电子式:A__________;X__________。
(2)工业上制取硝酸的反应有(填写反应代号)________________。
(3)写出下列物质的化学式 B_______;C_______
(4)反应④的化学方程式为______________________。
(5)保持容器的温度和体积不变,在反应③刚好完全反应时,反应前后容器的压强之比为________。
参考答案:(1)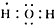 ;
;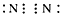 (2)⑤⑥⑦
(2)⑤⑥⑦
(3)Mg3N2;AgN3
(4)Ag+2HNO3(浓)=AgNO3+NO2↑+H2O
(5)5:7
本题解析:
本题难度:一般
2、填空题 (9分)X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如下转化关系:
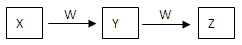
(1)若该反应是非氧化还原反应
①X为强碱溶液,W是形成酸雨的主要气体,则Y到Z的离子方程式为?。
②X是一种盐,逐滴加入W,溶液中开始无气泡,后产生无色无味气体Z,则Z的电子式为?。
(2)若该反应是氧化还原反应
①X常温下为黄绿色气体,W是生活中应用最广泛的金属之一,则Y的水溶液中加入W生成Z溶液的离子方程式为?。
②X常温下为气体化合物,Z是一种红棕色气体,X气体的检验方法?。X转化为Y的化学方程式为?。
参考答案:(1)①SO32-+SO2+ H2O=HSO3-(2分)?②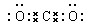 (2分)
(2分)
(2)①2Fe3+ + Fe = 3Fe2+(2分)
②湿润的红色石蕊试纸变蓝?(1分)? 4NH3+5O2=4NO+6H2O(2分)
本题解析:(1)形成酸雨的主要气体是SO2,所以Y是亚硫酸盐,亚硫酸盐继续吸收SO2,生成相应的酸式盐,所以离子方程式为SO32-+SO2+ H2O=HSO3-。碳酸盐和酸反应开始阶段不产生气体,当碳酸盐完全转化为碳酸氢盐后,再滴入酸才开始出现CO2气体。CO2是由极性键形成的共价化合物,其电子式为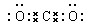 。
。
(2)黄绿色气体是氯气,应用最广泛的金属是铁,则Y是氯化铁,氯化铁氧化单质铁生成氯化亚铁,方程式为2Fe3+ + Fe = 3Fe2+。红棕色气体是NO2,则Y是NO,W是氧气,X是氨气。可以利用氨气是碱性气体进行检验,氨气发生催化氧化即生成NO,方程式为4NH3+5O2=4NO+6H2O。
本题难度:一般
3、实验题 聚合硫酸铁又称聚铁,化学式为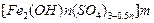 ,广泛用于污水处理。
,广泛用于污水处理。
某化学兴趣小组在实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、Si02等)
制备聚铁和绿矾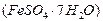 的过程如下:
的过程如下:

(1) 验证固体W焙烧后产生的气体含有SO2的方法是?。
(2) 实验室制各、收集干燥的SO2,所需仪器如下。装置A产生SO2,按气流方向连接各
仪器接口,顺序为a→?→?→?→?→f,装置D的作用是?,装置E中NaOH溶液的作用是?。

(3) 制备绿矾时,内溶液X中加入过量?,充分反应后,经?
操作得到溶液Y,再经浓缩,结晶等步骤得到绿矾。
(4)溶液Z的pH影响聚铁中铁的质量分数,用PH试纸测定溶渡pH的操作方法为?
?。
参考答案:(1) 将气体通入品红溶液,溶液褪色,加热恢复原色(合理即可)(3分)
(2) decb(2分)防止倒吸(2分)?吸收多余的SO2(2分)
(3) 铁屑(2分)过滤(2分)
(4) 将一小块pH试纸放在洁净干燥的表面皿上(或点滴板)上,用玻璃棒蘸取少量待测液沾在试纸上,与标准比色卡对照(3分)
本题解析:略
本题难度:一般
4、推断题 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)。
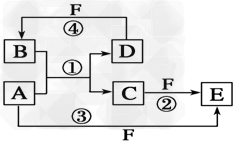
(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,则C的电子式为_________________,反应④的化学方程式为________________________。
(2)若A是常见的变价金属的单质,D、F是气态单质,且反应①在水溶液中进行。请写出在水溶液中进行的反应②的离子方程式_______________;已知光照条件下D与F反应生成B,写出该反应的化学方程式:_________________。
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为_________________。
参考答案:(1)“略”;C+4HNO3(浓)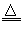 CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
(2)2Fe2++Cl2==2Fe3++2Cl-;H2+Cl2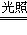 2HCl
2HCl
(3)2C+SiO2 Si+2CO↑
Si+2CO↑
本题解析:
本题难度:一般
5、简答题 A、B、C、D、E、F、G都是由短周期元素构成的粒子,它们都有10个电子,结构特点如下表:
| 粒子代号 | A | B | C | D | E | F | G
原子核个数
单核
单核
双核
四核
单核
五核
五核
电荷数
0
1+
1-
0
2+
1+
0
|
请填写下列空白:
(1)A粒子的结构示意图为______、D粒子的电子式为______、G粒子的化学式为______;
(2)BC和EC2的碱性强弱为BC______EC2(填:>、<或=);
(3)加热条件下,F与C在溶液中反应的离子方程式为______.
参考答案:A、B、C、D、E、F、G都是由短周期元素构成的粒子,它们都有10个电子.A为单核,电荷为0,则A为Ne原子;B为单核,电荷为+1,则B为Na+;C为双核,电荷为-1,则C为OH-;D为四核,电荷为0,则D为NH3;E为单核,电荷为+2,则E为 Mg2+;F为五核,电荷为+1,则F为NH4+;G为五核,电荷为0,则G为CH4.
(1)A为Ne原子,核外电子数为10,有2个电子层,最外层电子数为8,结构示意图为

;D为NH3,氮原子与氢原子之间形成1对共用电子对,电子式为

;G粒子为CH4,故答案为:

;

;CH4;
?(2)BC为NaOH,EC2为Mg(OH)2,金属性Na>Mg,所以碱性NaOH>Mg(OH)2,故答案为:>;
(3)F为NH4+,C为OH-,加热条件下,NH4+与OH-在溶液中反应生成氨气与水,离子方程式为 NH4++OH-?△?.?NH3↑+H2O,
故答案为:NH4++OH-?△?.?NH3↑+H2O.
本题解析:
本题难度:一般