1、选择题 在密闭容器中进行反应:2A(g)+B(g) 3C(g)+Q(Q>0)。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是
3C(g)+Q(Q>0)。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是
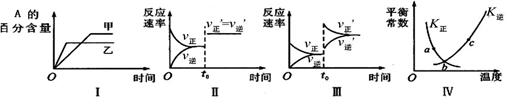
A.图I表示温度对化学平衡的影响,且甲的温度较高
B.图Ⅱ表示t0时刻缩小容器体积对反应速率的影响
C.图Ⅲ表示t0时刻增大B浓度对反应速率的影响
D.图Ⅳ中a、b、c三点中只有b点已经达到化学平衡状态
参考答案:B
本题解析:A、.图I甲反应速率小,温度较低,错误;B、该反应前后气体的物质的量不变,增大压强,正逆反应速率同等倍数的增大,化学平衡不移动,正确;C、图Ⅲ表示t0时刻增大B浓度,V逆与V逆’在t0时刻应该相连,错误;D、a、b、c都在平衡曲线上,都处于平衡状态,错误。
本题难度:一般
2、填空题 在一个2 L的密闭容器中,加入3 mol A和1 mol B,发生下述反应:
3A(g)+B(g)?2C(g)+3D(s),5 min达到平衡时,C的浓度为0.6 mol/L。
(1)达到平衡时,A的转化率为?,此温度下的平衡常数K=?。
(2)维持容器的温度不变,若缩小容器的体积,则平衡将向?(填“正反应方向移动”“逆反应方向移动”或“不移动”)。
(3)维持容器的体积和温度不变,向密闭容器中加入氦气,达到新平衡时,B、C的浓度之比 将?(填“增大”、“减小”或“不变”)。
将?(填“增大”、“减小”或“不变”)。
(4)当增加A的浓度,B的转化率?;若将C分离出来,化学平衡常数?。(填“增大”、“减小”或“不变”)
参考答案:(1)60% 8.33 ?(2)正反应方向移动 ?(3)不变 ?(4)增大 不变
本题解析:(1)根据各物质的速率之比等于化学计量数之比,也等于各物质的物质的量及浓度变化之比的原则进行“三段法”计算。

(2)温度不变而缩小容器体积,相当于加压,由于D为固体,正反应方向是气体体积减少的方向,所以平衡右移。
(3)由于维持体系的温度、容积不变,充入氦气不改变平衡中各物质的浓度,平衡不移动。
(4)若增加A的浓度,平衡右移,B的转化率增大;对于一个平衡来讲,平衡常数仅与温度有关,与浓度无关。
本题难度:一般
3、选择题 25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:
Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s),平衡时体系中c(Pb2+)和c(Sn2+)的浓度分别为
Sn2+(aq)+Pb(s),平衡时体系中c(Pb2+)和c(Sn2+)的浓度分别为
0.1 mol/L和0.2mol/L。下列判断正确的是
A.25℃时,该反应的平衡常数K=0.2
B.往平衡体系中加入金属铅后,c(Pb2+)增大
C.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变大
D.升高温度,平衡体系中c(Pb2+)增大,说明该反应△H>0
参考答案:C
本题解析:A项:应为K=2,故错;B项:加入固体的量,不影响化学平衡移动,故错;D项:正反应为放热发应,△H<0,故错。故选C。
点评:本题考查的是化学平衡移动原理及平衡常数的计算。难度大。注意化学平衡知识的学习。
本题难度:简单
4、选择题 在一定温度和压强下,下列各可逆反应达到化学平衡

状态,各反应有如图所示的对应关系:
(1)N2(g)+3H2(g) 2NH3(g)?△H<0(曲线Ⅰ)?
2NH3(g)?△H<0(曲线Ⅰ)?
(2)H2(g)+I2(g) 2HI(g)?△H>0(曲线Ⅱ)
2HI(g)?△H>0(曲线Ⅱ)
(3)2SO3(g) 2SO2(g)+O2(g)?△H>0(曲线Ⅲ)
2SO2(g)+O2(g)?△H>0(曲线Ⅲ)
则图像中y轴可以表示?(?)?
①平衡混合气中一种生成物的体积分数?②平衡混合气中一种反应物的体积分数?③平衡混合气中一种生成物的产率?④平衡混合气中一种反应物的转化率
A.①②③
B.①②④
C.①③④
D.②③④
参考答案:C
本题解析:对于反应(1),加压平衡正向移动,生成物的体积分数增加,生成物的产率增加,反应物的体积分数减小,反应物的转化率增加。
对于反应(2),加压平衡不移动,生成物的体积分数、生成物的产率、反应物的体积分数、反应物的转化率均不变。
对于反应(3),加压平衡逆向移动,生成物的体积分数减小,生成物的产率减小,反应物的体积分数增加,反应物的转化率减小 。
综上所述,答案为C。
本题难度:一般
5、计算题 (共10分)已知合成氨反应为:N2 + 3H2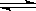 2NH3,在一定温度下,向2L密闭容器中,加入2molN2和5molH2,一定条件下使之反应,经过2min后达到平衡状态并测得NH3为0.4mol,求:
2NH3,在一定温度下,向2L密闭容器中,加入2molN2和5molH2,一定条件下使之反应,经过2min后达到平衡状态并测得NH3为0.4mol,求:
(1)以N2表示这2min内该反应的反应速率?
(2)此时氢气的转化率?
(3)平衡时NH3的体积分数?(保留1位小数)
(4)平衡时容器中的压强与开始压强之比?
(5)平衡时容器中气体的平均摩尔质量?
参考答案:(1)0.05 mol/L.min?(2)12%?(3)6.7% ?(4)33/35?(5)10g/mol
本题解析:N2 + ?3H2?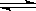 ?2NH3
?2NH3
2mol?5mol?0
0.2mol? 0.6mol? 0.4mol
1.8mol? 4.4mol? 0.4mol
V(N2)=0.2mol/2L.2min=0.05 mol/L.min?﹠H2=0.6mol/5mol=12%?
NH3℅=0.4mol/6.6mol="6.7%" ?p2/p1=n2/n1=6.6mol/7mol="33/35"
M=m/n=(28×2+5×2)/6.6mol=10g/mol
本题难度:一般