1、选择题 (10分)水是生命之源,也是化学反应中的主角。试回答下列问题:
I.A、B、C均是短周期元素组成的三种中学中常见的有色物质,摩尔质量依次增大,他们均能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂,请写出A、B、C与水反应的化学方程式:
(1)A+H2O??
(2)B+H2O??
(3)C+H2O??
II.已知X和Y分别是短周期两种同族元素形成的单质,W、V是化合物,它们有如下变化关系:W + X → Y + V ,试写出符合题意,且满足下列关系的化学方程式:
(1)W是H2O??
(2)V是H2O??
参考答案:I、A、B、C分别为NO2、Cl2和Na2O2 II、(1)2Na+2H2O =" 2NaOH" + H2↑
(2)2H2S + O2 = 2S↓+2H2O(每个方程式2分)
本题解析:略
本题难度:简单
2、填空题 已知常温下B、D、E、L为密度比空气大的气体,D、E为单质,其他为化合物。A是一种淡黄色固体,C微溶于水,F、G均能与L的水溶液反应放出B。据下边反应框图填空。
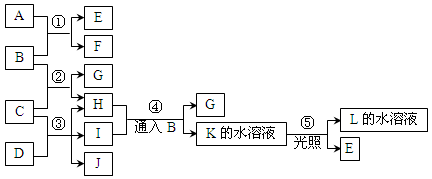
(1)F的俗名是?,B分子的结构式为________工业上利用反应③生产?。
(2)反应④的离子方程式为?。
(3)有一种单质能与H反应生成E,该反应的化学方程式为?。
(4)某气体M具有漂白作用,既有氧化性,又有还原性,M通入D的溶液中反应的离子方程式为?。
参考答案:(1)纯碱或苏打(1分),O=C=O?(1分)漂白粉(1分)
(2)Ca2++2ClO-+CO2+H2O=CaCO3+2HClO(2分)
(3)2F2+2H2O=4HF+O2(2分)
(4)SO2+Cl2+2H2O=SO42-+2Cl-+4H+(2分)
本题解析:A是一种淡黄色固体,且A是化合物,所以A是过氧化钠。A和B反应生成E和F,其中B、D、E、L为密度比空气大的气体,D、E为单质,所以B是CO2,E是氧气,F是碳酸钠。C微溶于水,F、G均能与L的水溶液反应放出B,这说明L应该是酸,因此L是氯化氢。C是氢氧化钙,氢氧化钙和CO2反应生成碳酸钙和水,即H是水。将CO2通入到I的水溶液中生成碳酸钙和K,K光照生成氯化氢和氧气,这说明K是次氯酸,所以I是次氯酸钙,J是氯化钙,D是氯气。
(1)碳酸钠的俗名是纯碱或苏大,CO2分子中含有碳氧双键,其结构式为O=C=O ,氯气与氢氧化钙反应可以制备漂白粉,所以工业上利用反应③生产漂白粉。
(2)碳酸的酸性强于次氯酸,因此CO2通入到次氯酸钙溶液中生成次氯酸,所以反应④的离子方程式为Ca2++2ClO-+CO2+H2O=CaCO3+2HClO。
(3)能和水反应生成氧气的单质可以是单质氟,反应的化学方程式为2F2+2H2O=4HF+O2。
(4)M具有漂白作用,既有氧化性,又有还原性,所以M是SO2,与氯气在水溶液中反应的离子方程式为SO2+Cl2+2H2O=SO42-+2Cl-+4H+。
本题难度:一般
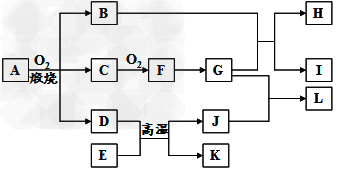
3、推断题 物质A-L之间的转化关系如图,部分反应物和生成物及反应条件已省略。化合物A是由三种元素组成的一种矿石的主要成分。A在氧气中高温煅烧生成B、C、D。B为砖红色固体,D、I均为红色固体,E、I、K是三种常见金属,其中组成E的元素是地壳中含量最高的金属元素。L可作净水剂,向L溶液中加入BaCl2溶液,会生成不溶于稀硝酸的白色沉淀,H溶液呈蓝色。
请回答下列问题:
(1)写出E和G的化学式:E_______、G_________。
(2)L可用作净水剂的原因是________________(用离子方程式表示)。
(3)写出B和G反应的化学方程式________________。
(4)D+E→K+J的反应中放出大量的热,这类反应被称为________反应,举出这类反应的一个应用实例:____________________?。
(5)A的相对分子质量为184,A与O2反应得到B、C、D三种物质的物质的量之比为1︰4︰1,某种检验葡萄糖的反应中含有B生成,则A的化学式为?___________。
(6)过量的I与含n?molG的浓G溶液共热生成m?molC,若给反应后的溶液中加入足量的K的粉末,则溶解掉K的质量为__________g(用含n和m的代数式表示)。
参考答案:(1)Al;?H2SO4
(3)Cu2O+H2SO4=CuSO4+Cu+H2O
(4)铝热;焊接钢轨或冶炼金属
(5)CuFeS2?
(6)56(n-m)
本题解析:
本题难度:一般
4、推断题 下图所涉及的物质均为中学化学中的常见物质,其中C为O2、D为Cl2、E为Fe单质,其余为化合物,它们存在如下转化关系,反应中生成的水及次要产物均已略去。
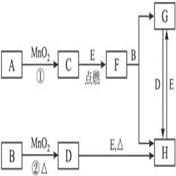
(1)写出有关物质的名称或化学式:
B_______________,F__________________,H____________________。
(2)指出MnO2在相关反应中的作用:反应①中是_________剂,反应②中是__________剂。
(3)若反应①是在加热条件下进行,则A是_____________;若反应①是在常温条件下进行,则A是_____________。
(4)写出B与MnO2共热获得D的化学方程式:__________________________________。
参考答案:(1)浓HCl? Fe3O4? FeCl3? (2)催化?氧化? (3)KClO3? H2O2?
(4) 4HCl+MnO2 MnCl2+H2O+Cl2
MnCl2+H2O+Cl2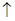
本题解析:A为H2O2;B为浓盐酸;C为O2;D为Cl2;E为Fe;F为Fe3O4;G为FeCl2;H为FeCl3。
(2)反应①为过氧化氢分解制氧气,MnO2做为催化剂,加快反应的进行。反应②中,MnO2做为氧化剂,与浓盐酸反应制备氯气。
(3)C为O2,实验室制备氧气的方程式中涉及到MnO2的有加热KClO3分解制氧气和H2O2分解制氧气。
(4)化学方程式为 4HCl+MnO2 MnCl2+H2O+Cl2
MnCl2+H2O+Cl2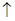
点评:已推断题的性质综合考查了氯气的制备以及氧气的制备,属于中档题。对推断题的解答,应注意寻找突破口。
本题难度:一般
5、推断题 A~J是中学化学中常见的几种物质,它们之间的转化关系如下图所示。已知常温下A为固体单质,B为淡黄色粉末,C、F、I为气态单质,E在常温下为液体,且E可由C、F化合生成,J可作杀菌消毒剂。
(1)写出B的电子式_______________________________。
(2)写出反应⑤的化学方程式:_________________________________。
(3)写出反应⑦的离子方程式:_________________________________。
(4)向AlCl3溶液中加入少量固体B,写出反应的化学方程式:___________________________ 。
(5)以Pt为电极电解滴加有少量酚酞的H饱和溶液,则________极(填“阴”或“阳”)附近溶液先由无色变为红色,请说明理由:_____________________________________。
参考答案:(1)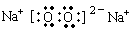
(2)2NaCl + 2H2O 2NaOH + Cl2↑ + H2↑
2NaOH + Cl2↑ + H2↑
(3)Cl2 + 2OH-= Cl-+ ClO-+ H2O
(4)4AlCl3+6Na2O2+6H2O = 4Al(OH)3↓+12NaCl+3O2↑
(5)阴;在阴极H+不断放电,破坏了水的电离平衡,促使水继续电离,导致溶液中c(OH-)>c(H+),所以阴极附近溶液变红。
本题解析:
本题难度:一般