1、选择题 从海水中提取溴有如下反应:5NaBr+NaBrO3+3H2SO4=3Br2+3Na2SO4+3H2O,与该反应在氧化还原反应原理上最相似的是?(?)
A.2NaBr+Cl2=2NaCl+Br2
B.AlCl3+3NaAlO2+6H2O=4Al(OH)3↓+3NaCl
C.3S+6KOH=2K2S+K2SO3+3H2O
D.NH4Cl+NaNO2=NaCl+N2↑+2H2O
参考答案:D
本题解析:根据反应5NaBr+NaBrO3+3H2SO4=3Br2+3Na2SO4+3H2O可知,该反应是同一种元素之间发生的氧化还原反应,且氧化产物和还原产物是同一种物质。据此可知选项D正确,其余选项都不符合,答案选D。
点评:该题是中等难度的试题,试题注重基础,侧重对能力的培养。该题的关键是准确判断出已知信息中包含的反应特点,然后进行类推即可,有助于培养学生的逻辑推理能力和发散思维能力。
本题难度:一般
2、选择题 对于反应 3 Cu + 8 HNO3 =" 3" Cu(NO3)2 + 2NO↑+ 4H2O,以下叙述正确的是(? )
A.氧化剂和还原剂的物质的量比为8: 3
B.被还原的HNO3和起酸性作用的HNO3的物质的量的比为2∶3
C.该反应的电子转移数为6e-
D.该反应中Cu(NO3)2为氧化产物,H2O为还原产物
参考答案:C
本题解析:
正确答案:C
A.不正确,8molHNO3中氧化剂只有2mol,氧化剂和还原剂的物质的量比为2: 3
B.不正确,被还原的HNO3和起酸性作用的HNO3的物质的量的比为1∶3
C.正确,3molCu失去6mol电子,该反应的电子转移数为6e-?
D.不正确,该反应中Cu(NO3)2为氧化产物,NO为还原产物
本题难度:简单
3、填空题 (6分)100mlA2气体跟50mlB2气体恰好完全反应,生成的气体体积为100ml(同温同压条件下),
试推断气体生成物的化学式____________________,
推断的依据是_____________________________________________________
参考答案:(6分)A2B或BA2?阿伏伽德罗定律和质量守恒定律
本题解析:根据阿伏伽德罗定律可知,生成物和反应物A2和B2的体积之比是2︰2︰1。再根据质量守恒定律可知,该物质的化学式是A2B或BA2 。
本题难度:一般
4、计算题 某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。
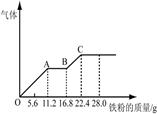
(1)两份各自产生的NO气体物质的量 (填“相等”或“不相等”)
(2)硝酸的物质的量浓度 ,硫酸的物质的量浓度 。
参考答案:(6分)(1)相等 (2分) (2)2mol·L-1 4mol·L-1 (各2分)(无单位扣一分)
本题解析:(1)根据Fe与稀硫酸、稀硝酸反应的图像判断,OA段是Fe与硝酸反应生成硝酸铁、NO、水,AB段气体的物质的量不再增加,且铁离子的氧化性大于氢离子的氧化性,所以AB端发生的是Fe与铁离子的反应生成亚铁离子,随后再加入Fe,又产生气体,说明BC段是Fe与稀硫酸反应产生氢气。说明硝酸根离子被全部还原为NO,则该混酸与Fe、Cu反应产生的NO相等;
(2)根据Fe与稀硫酸、稀硝酸反应的离子方程式可知Fe+4H++NO3-=Fe3++NO↑+2H2O,可知与100mL的混酸反应中,与硝酸反应的Fe的质量是11.2g,物质的量是11.2g/56g/mol=0.2mol,则硝酸根离子的物质的量也是0.2mol,所以硝酸的物质的量浓度是0.2mol/0.1L=2mol/L;当加入Fe的质量是22.4g时不再产生气体,此时反应停止,所得溶液为硫酸亚铁溶液,22.4gFe的物质的量是22.4g/56g/mol=0.4mol,则100mL溶液中硫酸的物质的量是0.4mol,物质的量浓度是0.4mol/0.1L=4mol/L。
考点:考查对图像的分析,Fe、Cu与稀硫酸、稀硝酸反应的计算
本题难度:一般
5、选择题 下图为反应Fe + CuSO4 ="==" Cu + FeSO4中电子转移的关系图,则图中的元素甲、乙分别表示
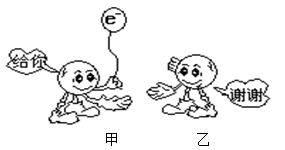
A. Fe ,S
B.Cu,S
C.Fe,O
D.Fe,Cu
参考答案:D
本题解析:略
本题难度:简单