1、选择题 下列说法错误的是
A.在氧化还原反应中,得到电子的元素化合价升高
B.物质中某元素得到电子的反应是还原反应
C.物质中某元素得到电子被还原,则此物质是氧化剂,它在反应中表现氧化性
D.还原剂的某元素在反应中被氧化后得到的是氧化产物
2、选择题 需加入适当的还原剂才能实现的反应是
A.PCl3 → PCl5
B.MnO2 → Mn2+
C.SO2 → SO3
D.Fe2O3→ Fe
3、填空题 氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:
NO3-+4H++3e- = NO+2H2O
KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:______________________________。
(2)反应中硝酸体现了_______性、_______性。
(3)反应中若产生0.2 mol气体,则转移电子的物质的量是_______mol。
(4)若1 mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是:_____________________。
4、填空题 在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性为氰化物的千分之一),氰酸盐进一步被氧化成无毒物质。
(1)某厂废水含KCN(其中N的化合价为-3价),其浓度为65mg/L。现用氯氧化法处理该废水,发生如下反应:KCN+2KOH+Cl2=KOCN+2KCl+H2O,其中被氧化的元素为______________,还原产物为
__________。
(2)投入过量的液氯,可将氰酸盐进一步氧化为无毒的稳定物质。
①在方框内填写生成的无毒的稳定物质的化学式,并在横线上填写配平的化学计量数:
?____KOCN+____KOH+____Cl2=____KCl+____CO2↑+____ +___H2O
+___H2O
②当反应中生成1mol CO2时转移的电子总数为_________NA。
(3)若处理上述废水20.0L,使KCN完全转化为无毒物质,至少需要液氯_______g。
5、实验题 (1)?利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍。
Ni(s)+4CO(g)?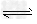 Ni(CO)4(g)?该反应的ΔH_________0?(选填“>”或“=”或“<”)。
Ni(CO)4(g)?该反应的ΔH_________0?(选填“>”或“=”或“<”)。
(2)?在高温下一氧化碳可将二氧化硫还原为单质硫。已知:
C(s)+O2(g)=CO2(g)?ΔH1=-393.5?kJ·mol-1
CO2(g)+C(s)=2CO(g)?ΔH2=+?172.5?kJ·mol-1
S(s)+O2(g)=SO2(g)?ΔH3=-296.?0?kJ·mol-1
请写出CO除SO2的热?化学方程式__________。
(3)?已知Na2CrO4溶液酸化时发生的反应为:2CrO42-+2H+? Cr2O72-+H2O,若1L酸化后所得溶液中铬元素的总?物质的量为0.55?mol,CrO42-有10/11转化为Cr2O72-。又知:常温时该反应的平衡常数K=1014。求上述酸化后所得溶?液的pH_________。
Cr2O72-+H2O,若1L酸化后所得溶液中铬元素的总?物质的量为0.55?mol,CrO42-有10/11转化为Cr2O72-。又知:常温时该反应的平衡常数K=1014。求上述酸化后所得溶?液的pH_________。
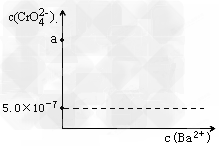
(4)?根据有关国家标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7?mol·L-1以下才能排放。含CrO42-的废水处理通常有以下两种方法。
①?沉淀法:加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入可溶性硫酸盐处理多余的Ba2+。加入可溶性钡盐后的废水中Ba2+的浓度应不小于_________mol·L-1,然后再进行后续?处理方能达到国家排放?标准。若原废水中CrO42-浓度为a?mol/L,请在图中画出c(CrO42-)与c(Ba2+)的关系图,并进行必要的标注。
②?还原法:CrO42-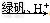 Cr3+
Cr3+ Cr(OH)3。用该方法处理10?m3?CrO42-的物质的量浓度为1.0×10-3?mol·L-1的废水,至少需要绿矾(FeSO4·7H2O,相对分子质量为278)__________Kg(保留两位小数)。
Cr(OH)3。用该方法处理10?m3?CrO42-的物质的量浓度为1.0×10-3?mol·L-1的废水,至少需要绿矾(FeSO4·7H2O,相对分子质量为278)__________Kg(保留两位小数)。