1、选择题 甲、乙、丙、丁四个烧杯内分别放人 0.1mol的钠、氧化钠、过氧化钠和氢氧化钠,然后各加入 100mL水,搅拌,使固体完全溶解,则甲、乙、丙、丁的质量分数大小的顺序是
A.甲<乙<丙<丁
B.丁<甲<乙<丙
C.甲=丁<乙=丙
D.丁<甲<乙=丙
参考答案:D
本题解析:钠、氧化钠、过氧化钠和水反应的方程式分别如下:
Na+H2O=NaOH+1/2H2↑,溶液增加的质量=m(Na)-m(H2)=2.3g-0.1g=2.2g;
Na2O+H2O=2NaOH,溶液增加的质量=m(Na2O)=0.1mol×62g/mol=6.2g;
Na2O2+H2O=2NaOH+1/2O2↑,溶液增加的质量=m(Na2O2)-m(O2)=m(Na2O)=6.2g
将氢氧化钠加入水中,溶液增加的质量为氢氧化钠的质量=0.1mol×40g/mol=4g;
所以溶液增加的质量大小顺序为:钠<氢氧化钠<氧化钠=过氧化钠
根据钠原子守恒知,0.1mol的钠、氧化钠、过氧化钠、氢氧化钠溶于水所得氢氧化钠的物质的量分别为:0.1mol、0.2mol、0.2mol,0.1mol
通过以上分析可知,0.1mol的钠、氧化钠、过氧化钠、氢氧化钠分别溶于水所得溶液的质量分数分别为:
 ×100%、
×100%、 ×100%、
×100%、![]() ×100%、
×100%、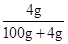 ×100%
×100%
所以甲、乙、丙、丁的质量分数大小的顺序是:丁<甲<乙=丙.
故选D.
本题难度:简单
2、选择题 将5.6克Fe在一定量稀硝酸中恰好完全溶解后,往溶液中滴加KOH溶液立即产生沉淀,滴加至沉淀量最大时,再将所得溶液和沉淀一起加热蒸干,并在空气中灼烧至恒重,所得固体成分和可能的质量为
A.Fe2O3:8gKNO2:12.7g
B.Fe2O3:8gKNO2:20.4g
C.Fe2O3:8gKNO2:31.5g
D.FeO:7.2gKNO3:16.4g
参考答案:B
本题解析:分析:根据5.6gFe与稀硝酸反应可能生成硝酸亚铁或硝酸铁两种情况计算,5.6gFe的物质的量为0.1mol,加入氢氧化钾后蒸干,滴加至沉淀量最大时,溶液为硝酸钾溶液,得到0.1mol铁的氢氧化物(氢氧化亚铁会被空气氧化)和0.2mol硝酸钾或硝酸钾0.3mol,蒸干并在空气中灼烧至恒重,最后得到0.05mol氧化铁和0.2mol硝酸钾或0.3mol亚硝酸钾,可分别计算出亚硝酸钾的质量范围.
解答:5.6gFe的物质的量为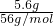 =0.1mol,
=0.1mol,
若铁全部恰好生成硝酸亚铁,根据铁元素守恒n[Fe(NO3)2]=n(Fe)=0.1mol,
加入氢氧化钾后,加热蒸干,并在空气中灼烧至恒重,固体为氧化铁与硝酸钾.
根据硝酸根子守恒可得n(KNO3)=2n[Fe(NO3)2]=2×0.1mol=0.2mol,
根据铁元素守恒可得n(Fe2O3)= n(Fe)=
n(Fe)= ×0.1mol=0.05mol,
×0.1mol=0.05mol,
所以固体质量是:氧化铁0.05mol×160g/mol=8g,亚硝酸钾0.2mol×69g/mol=13.8g
若铁全部恰好生成硝酸铁,根据铁元素守恒n[Fe(NO3)3]=n(Fe)=0.1mol,
根据硝酸根子守恒可得n(KNO3)=3n[Fe(NO3)2]=3×0.1mol=0.3mol,
加入氢氧化钾后,加热蒸干,并在空气中灼烧至恒重,固体为氧化铁与硝酸钾.
根据铁元素守恒可得n(Fe2O3)= n(Fe)=
n(Fe)= ×0.1mol=0.05mol,
×0.1mol=0.05mol,
所以固体质量是:氧化铁0.05mol×160g/mol=8g,亚硝酸钾0.3mol×69g/mol=20.7g
所以氧化铁质量是8g,亚硝酸钾质量在13.8g~20.7g之间.
故选:B.
点评:本题考查混合物的计算,题目难度较大,注意本题考虑5.6gFe与稀硝酸反应可能生成硝酸亚铁或硝酸铁两种情况计算,利用端值法求解.
本题难度:困难
3、选择题 在标准状况下,将NO、NO2、O2三种气体按一定比例充满一固定容积的容器,并将该容器倒置在水槽中,充分反应后,容器中无气体剩余,所得溶液的浓度为Mmol/L。则M的取值范围是
A.0B.1/39.2C.1/28D.1/39.2
参考答案:D
本题解析:设烧瓶容积为V升,采用极值法
当原混合气体全部为NO和O2时:4NO+3O2+2H2O=4HNO3,硝酸的物质的量为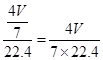 =mol,溶液的浓度为
=mol,溶液的浓度为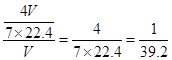 =mol/L
=mol/L
当原混合气体全部为NO2和O2时:4NO2+O2+2H2O=4HNO3,硝酸的物质的量为 =mol,溶液的浓度为
=mol,溶液的浓度为 mol/L
mol/L
故答案为D
本题难度:一般
4、选择题 用氯气跟单质化合不能制取的物质是
A.KCl
B.FeCl2
C.FeCl3
D.CuCl2
参考答案:B
本题解析:试题分析:铁在氯气中燃烧生成的氯化铁,得不到氯化亚铁,选项B不正确,其余选项都是正确的,答案选B。
考点:考查氯气和金属反应的产物判断
点评:该题是基础性试题的考查,难度不大。该题的关键是熟练记住金属单质和氯气的反应产物,属于识记性知识的检验。
本题难度:困难
5、选择题 amol的下列物质分别与足量的稀硝酸反应(假设还原产物只有一种),消耗硝酸的物质的量均可看作两部分,一部分为作氧化剂的硝酸,另一部分为作酸的(即以硝酸根离子的形式存在于反应后的溶液中维持溶液的电中性),下列各选项中正确的是(单位:mol)
①Fe:3a+a? ②Fe3O4:9a+? ③Fe(OH)2:3a+? ④FeSO4:a+
A.①②③④
B.只有①②
C.只有③④
D.只有①②③
参考答案:A
本题解析:根据题意硝酸足量,都生成三价铁,故起酸作用的硝酸都为铁元素的3倍,A、B、C、D中起酸作用的硝酸分别为3amol、9amol、3amol和amol;A中作氧化剂的硝酸为amol,B、C、D中作氧化剂的硝酸都是mol,故全部正确。
本题难度:简单