1、推断题 物质A有如下图所示转化关系,其中乙为金属单质,常温下,它在G?的浓溶液中发生钝化,?F?的溶液中只含有一种溶质(有的反应可能在水溶液中进行,有的反应的生成物未全部给出,反应条件也未注明)。
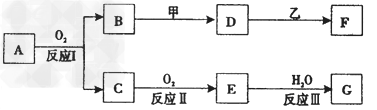
请讨论以下两种情况(注:两种情况下各字母代表的物质可能不同) 回答下列问题:
(1)第一种情况:用两根玻璃棒分别蘸取?A、G的浓溶液并使它们接近时,有大量白烟生成;甲为焰色反应呈黄色的金属单质;?D?和?F?的溶液均呈碱性。则:
①反应Ⅲ的化学方程式为_____________________。
②D与乙反应的离子方程式为_____________________。
(2)第二种情况:?甲由两种单质直接化合得到;B?为红棕色固体;?C为无色气体,是形成酸雨的大气污染物之一;D?的水溶液加入用硝酸酸化的AgNO3溶液有白色沉淀生成。则:
①工业上,反应?I的化学方程式为______________________________________。
②D和乙反应的离子方程式为____________________________________?。
③?请简述检验D溶液中阳离子的方法___________?。
④?若A的相对分子质量为120,反应Ⅰ、Ⅱ、Ⅲ均为完全转化。现取m克含A及少量杂质的样品,按上述过程充分反应后(杂质不参与反应),得到密度为ρg/cm3,溶质质量分数为a%?的G溶液n?mL。则该样品中A的质量分数=_____________(列出计算式即可)。
参考答案:(1)①3NO2+H2O=NO+2HNO3?
②2Al+2OH-+2H2O?=?2AlO2-+3H2↑
(2)①?4FeS2+11O2 2Fe2O3+8SO2
2Fe2O3+8SO2
②2Fe3+?+?Fe?=3Fe2+?
③取少量G溶液于一试管中,向其中滴入1~2滴硫氰化钾溶液,溶液呈现红色、则有三价铁离子?
④
本题解析:
本题难度:一般
2、判断题 (8分)某浅绿色溶液A中加入用硝酸酸化的硝酸银酸性溶液,生成白色沉淀B和黄色溶液C,再向溶液C中加入足量的氨水生成红褐色沉淀D。
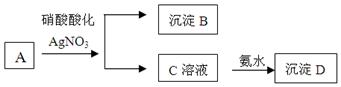
根据以上判断:
(1)A、B、C、D的化学式:A?B ?C?D?
(2)写出C到D反应的离子方程式?
(3)写出A和硝酸反应的化学方程式?
参考答案:(1)A: FeCl2? B: AgCl? C: FeCl3? D: Fe(OH)3
(2)Fe3++3NH3.H2O= Fe(OH)3↓+3NH4+
(3)3FeCl2 + 4HNO3 ="=" 2FeCl3 + Fe(NO3)3 + NO↑+ 2H2O
本题解析:浅绿色溶液A,说明A中含有Fe2+,加入用硝酸酸化的硝酸银酸性溶液,生成白色沉淀B和黄色溶液C,则B是AgCl,黄色溶液是Fe2+被氧化成Fe3+,说明A中含有Cl-,所以A是FeCl2,C是FeCl3。向C溶液加入足量的氨水生成红褐色沉淀D,则D是Fe(OH)3。
点评:化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识,还可引入学科间综合.它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法.。解框图题的方法:最关键的是寻找"突破口"!,"突破口"就是抓"特"字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等。
本题难度:一般
3、推断题 A~G各物质间的关系如下图,其中B、D为气态单质。请回答下列问题:
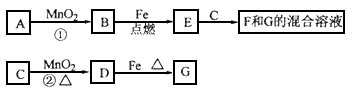
(1)物质C和E的名称分别为____________、_______________;
(2)可选用不同的A进行反应①,若能在常温下进行,其化学方程式为_____________;若只能在加热情况下进行,则反应物A应为_____________;
(3)反应②的化学方程式为_____________;
(4)新配制的F溶液应加入_____________以防止其转化为G。检验G溶液中阳离子的常用试剂是_____________,实验现象为________________。
参考答案:(1)浓盐酸;四氧化三铁;
(2) ;KClO3
;KClO3
(3)4HCl(浓)+MnO2 MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
(4)铁单质(如铁粉、铁钉、铁丝、铁棒、铁片等等);KSCN溶液(NH4SCN溶液NaSCN溶液等等);溶液变为红色(或血红色)。
本题解析:
本题难度:一般
4、简答题 a、b、c、d、e是含有一种相同元素的五种物质,可发生如图转化:其中:a是单质;b是气体;c、d是氧化物;e是最高价氧化物对应的水化物.
(1)如果a是一种淡黄色粉末固体,试推断这五种物质(用名称表示):
a______;b______;c______;d______;e______.
并写出由c生成d的化学方程式______
(2)如果a为单质且是一种常见气体,试推断这五种物质(用化学式表示):
a______;b______;c______;d______;e______.
并写出由d生成e的化学方程式______.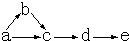
参考答案:淡黄色单质为硫,题中能发生连续氧化,对应的反应有硫和氮元素的转化:
(1)a物质是淡黄色粉末,且能够被连续两次氧化,所以a物质是非金属硫,b为硫化氢,c为二氧化硫,d为三氧化硫,e为硫酸,c生成d的反应为2SO2+O2催化剂
本题解析:
本题难度:一般
5、实验题 以食盐为原料进行生产并综合利用的某些过程如下图所示。
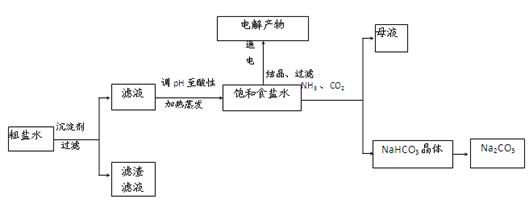
(1)除去粗盐中的Ca2+、Mg2+和SO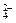 离子,加入下列沉淀剂的顺序是(填序号)?。
离子,加入下列沉淀剂的顺序是(填序号)?。
a.Na2CO3? b.NaOH? c.BaCl2 ?
(2)将滤液的pH调至酸性除去的离子是?。
(3)电解饱和食盐水反应的离子方程式是?。
(4)若向分离出NaHCO3晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的物质,其化学式是?。
(5)纯碱在生产生活中有广泛的应用。
①纯碱可用于除灶台油污。其原因是(结合离子方程式表述)?。
②常温下,向某pH=11的Na2CO3溶液中加入过量石灰乳,过滤后所得溶液pH=13。
则反应前的溶液中与反应后的滤液中水电离出的c(OH—)的比值是?。
③工业上,可以用纯碱代替烧碱生产某些化工产品。如用饱和纯碱溶液与Cl2反应制取有效成分为NaClO的消毒液,其反应的离子方程式是?。(已知碳酸的酸性强于次氯酸)。
参考答案:(1)(1分)c a b 或者 c b a或者b c a
(2)(1分)CO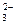 和OH—
和OH—
(3)(2分)2Cl-+ 2H2O 2OH-+ H2↑ + Cl2↑
2OH-+ H2↑ + Cl2↑
(4)(2分)NH3
(5)①(2分)CO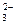 水解显碱性CO
水解显碱性CO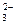 + H2O
+ H2O HCO
HCO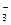 +OH—,油污在碱性条件下水解,达到去污目的。
+OH—,油污在碱性条件下水解,达到去污目的。
②(2分)1×1010
③(2分)2CO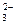 + Cl2 + H2O = Cl—+ ClO—+ 2HCO
+ Cl2 + H2O = Cl—+ ClO—+ 2HCO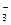
本题解析:略
本题难度:一般